
题目列表(包括答案和解析)
(四) 16
(三) 16
(二) 16
(一) 16
3.有一透明溶液,已知其中可能含有Fe2+、Mg2+、Cu2+、A13+、NH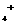 。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀量最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,当加入0.45mol粉末后,沉淀由0.3mol减少到0.2mol,再加入粉末后,沉淀就再减少。由实验现象及数据判断:
。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀量最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,当加入0.45mol粉末后,沉淀由0.3mol减少到0.2mol,再加入粉末后,沉淀就再减少。由实验现象及数据判断:
(1)淡黄色粉末的名称是___________;溶液中肯定有___________离子;肯定没有___________离子。
(2)写出下列反应的离子方程式:
①淡黄色粉末与水的反应:___________。
②刺激性气味气体产生的离子方程式:______________________。
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失的离子方程式:_________________________________________。
(3)溶液中离子的物质的量之比是___________。
答案:(1)Na2O2;Al3+、Mg2+、NH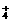 ;Fe2+、Cu2+
;Fe2+、Cu2+
(2)(略)
(3)NH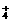 :A13+:Mg3+=1:1:2
:A13+:Mg3+=1:1:2
4.单质铁溶于稀硝酸的反应过程分析如下:
(1)当n(HNO3 )≥4n(Fe)时,发生反应的化学方程式为______________________。
(2)当n(HNO3 )≤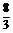 n(Fe)时,发生反应的化学方程式为______________________。
n(Fe)时,发生反应的化学方程式为______________________。
(3)当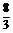 n(Fe)<n(HNO3)<4n(Fe)时,反应过程可以用通式表示:
n(Fe)<n(HNO3)<4n(Fe)时,反应过程可以用通式表示:
aFe+bHNO3(稀)=cNO↑+dFe(NO3)2+eFe(NO3)3+fH2O
①现假设a=16,且b、c、d、e、f均取正整数,将得到的多组系数配比填人下表(可不填满,也可补充)。
组别 a b c d e f
2.某待测液中可能含有Fe2+、Fe3+、Al3+、Ag+、Ba2+、Ca2+、NH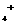 等离子,进行如下图所示的实验:
等离子,进行如下图所示的实验:
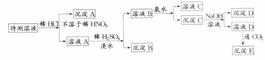 根据实验结果,回答下列问题:
根据实验结果,回答下列问题:
(1)判断溶液中有无Ba2+和Ca2+___________,并写出理由___________。
(2)沉淀D的化学式___________。
(3)写出溶液D生成沉淀E的化学方程式___________。
答案:(1)含有Ba2+和Ca2+中的一种或两种;因BaSO4不溶于水,CaSO4微溶于水
(2)Fe(OH)3 (3)2AlO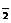 +CO2+3H2O=2Al(OH)3↓+CO
+CO2+3H2O=2Al(OH)3↓+CO
1.某化学兴趣小组在空气中加热硫粉和铁粉的混合物制取FeS。现有浓H2SO4、浓HNO3、稀HCI、稀HNO3、FeCl3溶液、KSCN溶液及氨水。简述用最简单可靠的实验方法,检验残存固体中是否含有少量的Fe2 O3。 _______________________________________________________。
答案:在残渣中加入盐酸和KSCN溶液,当溶液出现血红色,则证明残渣中有Fe2O3
16.在1L某稀HNO3溶液中加入14g铁粉,铁粉全部溶解,并放出NO气体。反应后溶液的体积为1L,而质量却比原溶液增加了8g。求:
(1)所得溶液中,金属离子的物质的量浓度。
(2)原稀HNO3的物质的量浓度(硝酸恰好完全反应)。
答案:(1)c(Fe2+)=0.15mol/L c(Fe3+)=0.1mol/L
(2)c(HNO3)=0.8mol/L
拓展练习
15.将一块生锈的铁片置于稀HNO3中充分反应,共收集到NO11.2L(标准状况下),溶液中还剩5g固体残渣。过滤后,向滤液中通入11.2L(标准状况下)氯气,恰好使溶液中的亚铁离子全部氧化,计算原铁片和铁锈的质量分数(铁锈的成份以Fe2O3计)。
答案:w(Fe2O3)=20.5%
14.现有100mLFeCl3、FeCl2、CuCl2的混合液,其中各物质的浓度均为lmol/L,在该混合液中加入一定量的铁粉。
(1)当反应完毕后,铁粉有剩余,此时一定含有的金属离子是___________,其物质的量是___________;不含有的金属离子是___________;所得固体的成分是___________,其质量比反应前加入铁粉的质量___________。(填“多多少克”或“少多少克”)
(2)当反应完毕后,如果没有固体物质存在,反应后的溶液中一定存在的离子是___________,其中物质的量为定值的金属离子是___________,它的物质的量是___________。
答案:(1)Fe2+;0.35mol;Cu2+,Fe3+;Fe,Cu;少2g
(2)Fe2+、Cu2+;Cu2+;0.1mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com