
题目列表(包括答案和解析)
1.用黄铜矿炼铜按反应物和生成物可将总反应写成:
CuFeS2+Sio2+O2→Cu+FeSiO3+SO2
事实上冶炼反应是分几步进行的:①黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;②硫化亚铁在氧气的作用下生成氧化亚铁,并与SiO2反应生成矿渣;③硫化亚铜与氧气反应生成氧化亚铜;④硫化亚铜与氧化亚铜反应生成铜。
(1)写出上述各步反应的化学方程式
①______________________ ②______________________
③______________________ ④______________________
(2)配平总反应的化学方程式___________。
(3)据最新报道,有一种叫ThibaciLLusferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的,试写出配平的化学方程式。
答案:(1)①2CuFeS2+O2 Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
②2FeS+3O2 2FeO+2SO2,FeO+SiO2
2FeO+2SO2,FeO+SiO2 FeSiO3
FeSiO3
③2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
④Cu2S+2Cu2O 6Cu+SO2
6Cu+SO2
(2)2CuFeS2+2SiO2+5O2 2Cu+2FeSiO3+4SO2
2Cu+2FeSiO3+4SO2
(3)4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O
4CuSO4+2Fe2(SO4)3+2H2O
13.将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热。
(1)可能发生的反应有:
①FeO+C=Fe+CO↑ ②2FeO+C=2Fe+CO2↑
③FeO+CO=Fe+CO2↑ ④_____________________
(2)若n< ,充分反应后,反应器中的固体物质是___________,气体产物是___________。
,充分反应后,反应器中的固体物质是___________,气体产物是___________。
(3)若n>4,充分反应后,反应器中的固体物质是___________,气体产物是___________。
(4)若反应的气体产物是混合物___________,n的取值范围是___________。
(5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n值为___________。
答案:(1)c+CO2 2CO (2)FeO,Fe;CO2
2CO (2)FeO,Fe;CO2
(3)C和Fe;CO (4)CD、CO2; <n<1 (5)
<n<1 (5) 
拓展练习
 12.在一定条件下,用普通铁粉和水蒸气反应可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以称为“引火铁”。实验中必须使用的普通铁粉和6mol/L的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备在图4-5中均已略去)
12.在一定条件下,用普通铁粉和水蒸气反应可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以称为“引火铁”。实验中必须使用的普通铁粉和6mol/L的盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备在图4-5中均已略去)
填写下列空白:
(1)实验进行时试管A中应加入的试剂是___________;烧瓶B的作用是___________,烧瓶C的作用是___________;在试管D中收集到的是___________。
(2)实验时,U型管G中应加入的试剂是___________;长颈漏斗H中应加入___________。
(3)两套装置中,在实验时需加热的仪器是(填仪器对应的字母)___________。
(4)试管E中发生反应的化学方程式是_________________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须___________;E管中的反应开始后,在F出口处应___________。
答案:(1)普通铁粉;水蒸气发生器;防止倒吸(安全瓶);H2 (2)固体NaOH(或碱石灰);HCl (3)A、B、E (4)Fe3O4+4H2 3Fe+4H2O (5)检验H2的纯度;点燃H2
3Fe+4H2O (5)检验H2的纯度;点燃H2
10.电子工业常用30%的FeCl3溶液腐蚀敷在塑料板上的铜箔,制成印刷线路板。现拟采用以下实验步骤,从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液,请在各步骤的括号内填写适当的试剂或生成物的化学式。
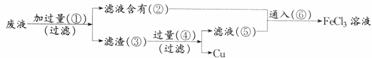
答案:①Fe;②FeCl2;③Fe和Cu;④HCl;⑤FeCl2;⑥Cl2
 11.在一定条件下可实现下图所示物质间的变化。已知A、D、E、I为气体,I与C、F、G的反应都在I的水溶液中进行的,A-I九种物质中有四种单质。
11.在一定条件下可实现下图所示物质间的变化。已知A、D、E、I为气体,I与C、F、G的反应都在I的水溶液中进行的,A-I九种物质中有四种单质。
请填写下列空白:
(1)B是___________,四种单质所对应的字母和化学式分别是___________。
(2)B和C是在近100℃的温度下发生反应的,写出此反应的化学方程式_________________________________。
C在D中燃烧的化学方程式___________。
答案:(1)H2O;A:Cl2 C:Mg E:H2 H:C
9.把A1C13溶液蒸干灼烧,最后得到的固体产物是___________,原因是____________________________________________。
答案:Al2O3;AlCl3在水中存在着水解平衡:A13++ 3H2O⇌AI(OH)3+3H+,蒸干过程中,促进AlCl3的水解,造成Al(OH)3沉淀,灼热后分解为Al2O3
8.已知有关物质的熔沸点如下:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点(°C) |
2852 |
2072 |
714 |
190(2.5×105Pa) |
|
沸点(°C) |
3600 |
2988 |
1412 |
182.7 |
参考上表数据回答以下问题:
(1)为什么工业上常用电解熔融MgCl2的方法生产金属镁,而不用电解熔融MgO的方法生产镁?
___________________________________________________________________________________________________________。
(2)工业上用电解Al2O3与冰晶石熔融混合物的方法生产Al,而不用电解ALCl3的方法生产铝,冰晶石在炼铝过程中的作用是什么?
_____________________________________________________________________________________________________。
答案:(1)从表中数据可以看出,MgO的熔点远高于MgCl2,若电解MgO需更高的温度,不便于操作
(2)从表中AlCl3熔、沸点可以看出,AlCl3易升华,属于分子晶体,难以电解,炼铝时用冰晶石作助熔剂,用以降低衄2Q的熔点,使电解在较低温度(约1000℃)下进行
7.A、B、C是中学化学中常见的单质,甲、乙两化合物在常温下分别为黑色晶体和无色液体。这些化合物和单质之间存在如右图所示的 关系:
(1)若元素A有可变化合价,则单质A的化学式为___________,甲的化学式为___________。
(2)甲还能和另一种常见金属在一定温度下发生反应,并放出大量的热,写出该反应的化学方程式______________________。
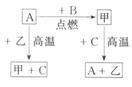 (3)简述甲+C
(3)简述甲+C A+乙反应如何才能充分进行?_________________________________。
A+乙反应如何才能充分进行?_________________________________。
答案:(1)Fe;Fe3O4 (2)3Fe3O4+8Al 9Fe+4A12O3
9Fe+4A12O3
(3)此反应在一定条件下是可逆反应,需不断地通入H2,导出生成的水蒸气
6.有A、B、C三种溶液,各含有Fe3+、Cu2+、Ag+中的一种,向A中加入适量铁粉,有红色固体析出,再加入C溶液,红色物质溶解,但无新固体物质析出,则A、B、C依次为( )。
A.Fe3+、Cu2+、Ag+ B.Cu2+ 、Ag+、Fe3+
C.Ag+、Fe3+、Cu2+ D.Cu2+、Fe3+、Ag+
答案:B
5.铁、钴、镍的原子序数分别是26、27、28,它们的性质相似,被称为铁系元素。已知有下列反应方程式:
Fe2O3+6HCl=2FeCl3+3H2O,Co2O3+6HCl=2CoCl2+C12↑+3H2O
结合过去所学的知识,推断氧化能力从高到低的顺序为( )。
A.C12>Co2O3>Fe2O3 B.Co2O3>Cl2>Fe2O3
C.Fe2O3>Co2O3>C12 D.Cl2>Fe2O3>Co2O3
答案:B
4.有些反应从表面看不能进行,如:
(1)KClO3(固)+H2SO4(液)→HClO3+KHSO4
(2)Na+KCl→NaCl+K
(3)Mg+RbCl2→MgCl2+Rb
(4)KCl+NaNO3→KNO3+NaCl
而实际上恰能制取带横线的物质,从化学原理上看,应用到相同原理的是( )。
A.①④ B.②③ C.①②③ D.①②③④
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com