
题目列表(包括答案和解析)
6.在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K= (K为A与n的比值)。下列推理正确的是
(K为A与n的比值)。下列推理正确的是
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强强
D.当K=l时,则该元素系过渡元素,当K<1时,则该元素系金属元素
5.具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s1 B.1s22s22p3
C.1s22s22p2 D.1s22s22p63s23p4
4.人们把电子云轮廓图称为原子轨道,下列有关说法错误的是
A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散
B.p电子的原子轨道都是哑铃形的,每个p能级有3个原子轨道,它们相互垂直能量不同
C.当电子排布在同一能级的不同轨道,总是优先单独占据一个轨道,而且自旋方向相同
D.在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋方向相反
3.由原子轨道相互重叠形成的σ键和π键总称价键轨道,是分子结构的价键理论中最基本的组成部分。关于该理论下列有关认识不正确的是
A.σ键不属于共价键,是另一种化学键
B.s-sσ键与s-pσ键的对称性相同
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
2.请依据原子核外电子填充规律,分析氢原子的3d和4s能级的能量高低是
A.无3d、4s轨道,无所谓能量高低 B.3d>4s C.3d=4s D.3d<4s
1.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是微小的实心球体;②同种原子的质量和性质都相同;③原子不能用物理方法分割。从现代原子--分子学说的观点看,你认为不正确的是
A.只有① B.只有② C.只有③ D.①②③
33.(13分)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,进行以下实验:
(1)检验吸收液中的SO42–: __________
_____________________________________________ ,证明Fe3+能够把H2SO3氧化成SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的还原剂是 _____ (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL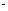 L-1KMnO4、0.1moL
L-1KMnO4、0.1moL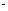 L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:用试管取样品溶液2-3mL,再用滴管取
|
若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
|
步骤2:
|
结合步骤1的现象和结论,
________________________________________. |
31.(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g) 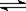 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为:________________________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是: ________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 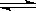 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O
( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4min之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
32(13分)实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
 (1)溶解大理石时,用硝酸而不同硫酸的原因是
_____________ 。
(1)溶解大理石时,用硝酸而不同硫酸的原因是
_____________ 。
(2)操作Ⅱ的目的是 ____ ,溶液A(溶质是共价化合物)是 。
(3)写出检验滤液B中是否含NH4+离子方法: _______
_________________________________________________________________________
(4)写出加入碳酸铵所发生反应的离子方程式: _______ 。写出滤液B的一种用途: 。
30.(16分) 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

 (1)写出G的含氧官能团的名称_____________________________________;
(1)写出G的含氧官能团的名称_____________________________________;
(2)B→C的反应类型是 。
(3)A与银氨溶液反应有银镜生成,则A的结构简式是 。写出A和银氨溶液水浴加热反应的化学方程式:______________________________________________;
(4)E的结构简式是 ;
(5)下列关于G的说法正确的是
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
23.常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是
A.①与②中c(H+)相同
B.①与④混合,所得混合液的PH等于7
C.②和③混合,所得混合溶液的pH大于7
D.③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com