
题目列表(包括答案和解析)
4、四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4 ; ②1s22s22p63s23p3 ; ③1s22s22p3 ; ④1s22s22p5。下列说法中正确的是( 0.3 )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>①>③=②
3、气态中性原子失去一个电子变成气态离子,其原子核外电子排布发生如下变化,吸收能量最多的是( 0.3 )
A. 1s22s22p2→1s22s22p1 B. 1s22s22p4→1s22s22p3
C. 1s22s22p3→1s22s22p2 D. 1s22s22p63s23p2→1s22s22p63s23p1
2、下列说法中不正确的是( )
A.IBr分子中,Br为-1价
B.2p3表示2p能级有三个轨道
C.基态18O原子中有8种运动状态完全不同的电子
D.某元素原子的价电子排布为nsn-2npn+1,该元素位于第4周期ⅦA族
1、下列轨道表示式能表示氮原子的最低能量状态的是( )
A.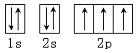 B.
B.
C. D.
D.
36. (13分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
(13分)相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
Ⅰ  Ⅱ
Ⅱ 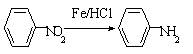

(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴ H的结构简式是 ;
⑵反应②、③的类型分别是 , 。
⑶反应⑤的化学方程式是 ;
⑷ 阿司匹林最多消耗 mol NaOH;
⑸  有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;
⑹ 请用合成反应流程图表示出由A和其他无机物合成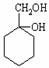 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
 流程图示例:
流程图示例:
河北衡水中学2010-2011学年度第二学期期末考试
35、(8分)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在BGO中,锗处于其最高价态。②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子稳定结构。③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。
请填空::
(1)锗在周期表中的位置
(2)BGO晶体的化学式是 _ _.
(3)铋的最高价氧化物的化学式是 .____
(4)与锗同周期的其他元素的基态原子中,未成对电子数最多的元素是 (填元素符号),该元素的基态原子电子排布式为
34、(8分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,
难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的
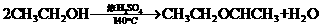 反应原理是
反应原理是
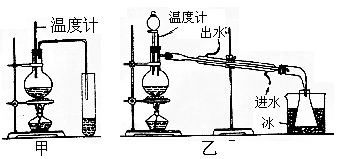
(1) 图甲和乙是两套实验室制乙醚的装置,选装置 最合适。
(2) 反应液中应加入沸石,其作用是 。
(3) 反应中温度计的位置是 。
(4) 用装置乙制得的乙醚中可能含有大量的乙醇,除去乙醇的简易方法是 。
(5) 如果温度太高将会发生另一有机反应,此反应方程式为
。
33、(9分)PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:
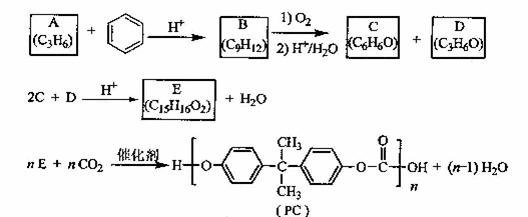
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。请回答下列问题:
(1)A的化学名称是
(2)B的结构简式为
(3)D有多种同分异构体,其中能发生银镜反应的是 简式
(4)C与D反应生成E的化学方程式为
(5)B的同分异构体中含有苯环的还有 种,其中在核磁共振氢谱中出现两组峰,且峰
面积之比为3:1的是 (写出结构简式)。
32、(改编、10分)主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍,Z元素的基态原子的最外层一个未成对电子,在由元素W、X、Y、Z组成的所有可能的二组分化合物中,由元素W与Y形成的化合物M的熔点最高。请回答下列问题:
(1)W元素与X元素相比,电负性X大于W,下列能证明这一事实的是 (填选项序号)
A.常温下X单质的颜色比W单质的颜色深
B.X单质与W的氢化物剧烈反应,产生W的单质
C.X与W形成的化合物中X元素呈负价态
D.比较两元素的单质与氢气化合时得电子的数目‘
(2)化合物M的化学式为 ,其晶体结构与NaCl相同,而熔点高于NaCl。M熔点较高的原因是 。将一定量的化合物ZX负载在M上可制得ZX/M催化剂,用于催化碳酸二甲酯与月桂醇酯交换合成碳酸二月桂酯。在碳酸二甲酯分子中,碳原子采用的杂化方式有 ,O-C-O的键角约为 ;
(3)灼烧含元素Z的盐,会使火焰呈现特殊的颜色,请用原子结构的知识解析其原因: 。
31. (12分) 水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。根据下列信息回答问题:
(1)基态氧原子价层电子的电子排布图为____________
(2)写出两种与H2O分子互为等电子体的微粒 、
(3)下列关于水的说法正确的是__________(选填序号)。
A、纯水呈中性,所以在任何条件下纯水的pH均为7;
B、水分子是由极性键构成的极性分子;
C、水在化学反应中可以作氧化剂,也可以作还原剂;
D、水分子中既含σ键,又含有π键;
(4)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒的化学性质发生了改变
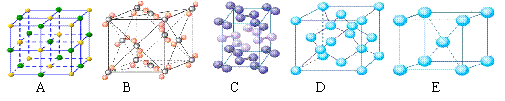
(5)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是 (请用相应的编号填写)
 (6)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(7)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com