
题目列表(包括答案和解析)
5.COCl2(g)  CO(g) + Cl2(g);⊿H>0 。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g) + Cl2(g);⊿H>0 。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度
④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A、①②④ B、①④⑥ C、②③⑤ D、③⑤⑥
4.下列实验装置(固定装置略去)和操作正确的是

3.已知 H2(g) + Br2(l) = 2HBr(g);⊿H = - 72kJ/mol ,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为
A、404 B、260 C、230 D、200
2.下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样提高原料转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
1.以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能 B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学 D.尽量用纯液态有机物代替水作溶剂
19、(24分)氮是地球上极为丰富的元素。填写下列空白。
(1)NH4+中N原子的杂化轨道类型为_____________,
NH4+的空间构型为_____________。
(2)常温下,锂可与氮气直接反应生成Li3N,Li3N晶体中氮以N3-存在,基态N3-的电子排布式为:__________________,Li3N晶体属于______________晶体(填晶体类型)。
(3)NH3的沸点为234K,NF3的沸点为154K,两者结构相似,NH3的沸点高于NF3的原因是:
_________________________________________________________________。
(4)CO与N2相似,分子中都存在一个共价叁键,CO含_____个π键。下表为CO与N2的相关信息。根据表中数据,说明CO比N2活泼的原因:
|
化学键 |
C-O |
C=O |
C≡O |
|
键能/kJ•mol-1 |
351 |
803 |
1071 |
|
化学键 |
N-N |
N=N |
N≡N |
|
键能/kJ•mol-1 |
159 |
418 |
946 |
_________________________________________________________________。
(5)根据下表数据,写出氮气与氢气反应生成氨气的热化学方程式。
_____________________________________________________。
|
化学键 |
N-N |
N=N |
N≡N |
N-H |
H-H |
|
键能/kJ•mol-1 |
159 |
418 |
946 |
391 |
436 |
(6)CO与N2互为等电子体,其碳原子上有一对孤对电子,因此可作配体,如:Fe(CO)5、Ni(CO)4、Cr(CO)6等,在合成氨工业上中用铜洗液吸收CO,反应如下:
[Cu(NH3)2]Ac + CO + NH3 = [Cu(NH3)3CO]Ac
醋酸二氨合铜(I) 醋酸羰基三氨合铜(I)
①基态Fe原子的未成对电子数有________个,
写出Cr、Cu+的价层电子排布式。_______________、_______________。
②醋酸二氨合铜(I)和醋酸羰基三氨合铜(I)都是配合物,[Cu(NH3)3CO]+中提供孤对电子的分子是:______________________,接受孤对电子的离子是:______________,用箭号标出[Cu(NH3)2]+形成的配位键:___________________________,[Cu(NH3)2]+中两个配位键的键角为180°,则Cu+采取_________杂化与NH3形成配位键(填杂化类型)。
③Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(7)氮化硅是一种高温陶瓷材料,它硬度大、熔点高、化学性质稳定。
①氮化硅晶体属于________________晶体(填晶体类型);
②已知氮化硅晶体结构中,原子间都以共价键相连,且N原子与N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子结构,请写出氮化硅的化学式:_________________。
(8)极纯的氮气可由叠氮化钠(NaN3)加热分解而得到。2NaN3(s)=2Na(l)+3N2(g),反应过程中,断裂的化学键是离子键和共价键,形成的化学键有________________________。
18、(12分)A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;E与F同周期,E的第一电离能高于F;G与F同主族。请回答下列问题:

(1)写出G元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素第一电离能由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于分子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,14g B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
17、 (16分)研究物质的微观结构,有助于人们理解物质性质和变化的本质。请回答下列问题。
(1)CH4中H为+1价,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序是:__________________。C60和金刚石都是碳的同素异形体,金刚石的熔点高于C60,原因是:________________________________________
__________________。C60被发现后,科学家又合成了结构相似的Si60、N60等,C60、Si60、N60三者的熔点从高到低的顺序是:___________________________。
(2)A、B均为短周期金属元素。依据下表数据和已学知识,写出B原子的电子排布式:____________________________。
|
电离能/kJ•mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
932 |
1821 |
15390 |
21771 |
|
B |
738 |
1451 |
7733 |
10540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1-d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+___________颜色,[Zn(H2O)6]2+___________颜色,(填“无”或“有”)
(4)CO与Cl2在催化剂作用下生成COCl2,COCl2俗称光气,极毒,光气分子


呈平面三角形,结构式为 ,则其碳原子的杂化类型是_______, COCl2分子内含有____________(填标号)
A.4个σ键 B.2个σ键、2个π键
C.3个σ键、1个π键 D.2个σ键、1个π键
16、科学家发现的钇钡铜氧化合物在90K具有超导性,若该化合物晶体的晶胞结构如图所示,则该化合物的化学式可能是( 0.3 )
A. YBa2Cu3O3.25
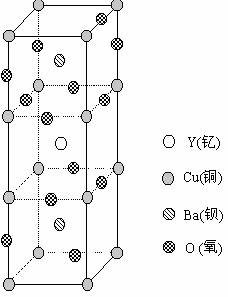 B.YBa2Cu2O5
B.YBa2Cu2O5
C.YBa2Cu3O5
D.YBaCu2O3.25
第Ⅱ卷
15、根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体。等电子体之间结构相似、物理性质相近。以下各组粒子不能互称为等电子体的是( )
A. CO和N2 B. O3和SO2 C. N2H4和 C2H4 D.CO2和N2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com