
题目列表(包括答案和解析)
15.(19分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH = -90.8 kJ·mol-1
CH3OH(g) ΔH = -90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
CO2(g)+ H2(g) ΔH= -41.3 kJ·mol-1
总反应:3H2(g)+ 3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)是多少?该时间内反应速率v(CH3OH)是多少?
14.物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是
A.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
B.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)
C.Y-、Z-两种酸根均能水解,X-不能水解
D.HX、HY、HZ三种酸的还原性由强到弱的顺序为HZ>HY>HX
第Ⅱ卷(本卷共4题,共54分)
13.下列表述正确的是
A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)
B.中和等体积、等pH值的盐酸和CH3COOH溶液所消耗的NaOH物质的量不相同
C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合后,所得溶液中都有
c(H+)+c(M+)=c(OH-)+c(A-)
D.25℃时,在水电离出H+浓度为1×10-12mol/L的溶液中,K+、Mg2+、NO3-、I-一定能大量共存
12.25 ℃时,水的电离达到平衡:H2O 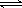 H+ + OH- ,ΔH
> 0 ;下列叙述正确的是
H+ + OH- ,ΔH
> 0 ;下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH减小。
11.在恒温、恒压下,反应N2 (g)+3H2
(g) 2NH3
(g)从两条途径分别建立平衡:
2NH3
(g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是
A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同
B.途径Ⅰ的反应速率v (N2)与途径Ⅱ的反应速率v (NH3)的比值为1∶2
C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2
D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶1
10.将0.1mol·L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时都会引起
A.溶液的pH增加 B.溶液中的c(H+)增大
C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
9.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A. 滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D. 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
8. 右图是关于反应A2(g)+3B2(g)
右图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
7.下列事实一定能说明HNO2是弱电解质的是
①常温下,NaNO2溶液的pH大于7;②用HNO2溶液做导电性实验,灯泡很暗;③0.1mol/L的HNO2溶液的pH为2.1;④常温下,将pH=3的HNO2稀释100倍后,pH<5
A.①②③ B.②③④ C.①③④ D.①②③④
6.pH = 2的两种一元酸 x 和 y ,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH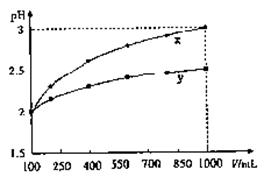 溶液(c = 0.1mol/L)至pH = 7,消耗NaOH 溶液的体积为Vx、Vy,则
溶液(c = 0.1mol/L)至pH = 7,消耗NaOH 溶液的体积为Vx、Vy,则
A、x为弱酸,Vx<Vy
B、x为强酸,Vx>Vy
C、y为弱酸,Vx<Vy
D、y为强酸,Vx>Vy
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com