
题目列表(包括答案和解析)
12.铜板上铁铆钉若较长时间地浸泡在海水中会生锈甚至腐烂,其腐蚀原理如右图所示。下
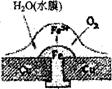 列有关此过程的说法不正确的是
列有关此过程的说法不正确的是
A.正极上的主要电极反应式为;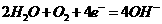
B.此过程中铜并未被腐蚀
C.电子从Cu流向Fe
D.此过程中还可能涉及到反应: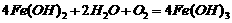
11.常温时,将V1mLcl mol/L的氨水滴加到V2mL c2 mol/L的盐酸中,下列结论正确的是
A.若Vl=V2,cl=c2,则溶液中一定存在c(H+)=c(OH-),是中性
B.若混合溶液的pH=7,则溶液中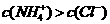
C.若混合溶液的pH=7,则一定存在c1V1>c2V2关系
D. 若V1=V2,并且混合液的pH<7,则一定是由于盐酸过量而造成的
9. 在pH=0的溶液中,能大量共存的离子组是
A. 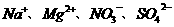 B.
B. 
C.  D.
D.
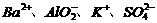
lO.下列有关热化学方程式的叙述正确的是
A.已知C(石墨,s)=C(金刚石,s) △H>O,则金刚石比石墨稳定
B.已知2H2(g)+O2(g)=2H20(1) △H=-571.6 kJ/mol,则氢气的燃烧热为285.8kJ/mol
C.含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋
酸和稀NaOH溶液反应的热化学方程式为:
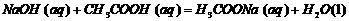

D.已知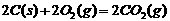
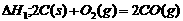
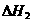 则△H1>△H2
则△H1>△H2
8.在已达到电离平衡的0.1mol/L的CH3COOH溶液中,欲使平衡向电离的方向移动,同时
使溶液的pH降低,应采取的措施是
A.加少量盐酸 B.加热
C. 加少量醋酸钠晶体 D.加水
只有一个选项符合题目要求,选对的得4分,选错或不答的得0分。
7.下列溶液一定是碱性的是
A.能使甲基橙变黄色的溶液 B.C(OH-)>1×10-7mol/L的溶液
C. 含有OH-的溶液 D.C(OH-)>c(H+)的溶液
31.[化学-有机化学基础](13分)
某种医药中间体G,常用来制备抗凝血药,其结构简式是: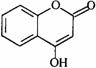 。
。
(1)G中含氧官能团是 。
(2)下列关于G的说法正确的是 。
a.能与溴单质反应 b.能与金属钠反应
c.1 molG最多能和3 mol氢气反应 d.分子式是C9H7O3
可通过下列路线合成此医药中间体:
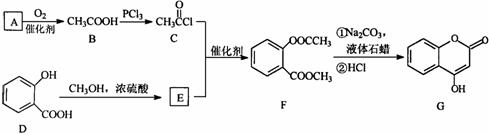
请回答下列问题:
(3)A与银氨溶液反应有银镜生成,则A的结构简式是 ;B→C的反应类型是 。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
。
(5)E的结构简式是 ;与D互为同分异构体且含苯环、属于酯类的有机物有 种。
30.[化学--物质结构与性质](13分)
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是 (用元素符号表示)
(2)A、B、C为同一短周期金属元素。依据下表数据分析,C元素在化合物中的主要化合价为 ;第二电离能(I2)B小于A的原因是 。
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
500 |
4600 |
6900 |
9500 |
|
B |
740 |
1500 |
7700 |
10500 |
|
C |
580 |
1800 |
2700 |
11600 |
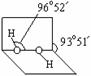 (3)已知过氧化氢分子的空间结构如右图所示,分子中
(3)已知过氧化氢分子的空间结构如右图所示,分子中
氧原子采取 杂化;通常情况下,H2O2与水
任意比互溶的主要原因是 。
(4)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+ 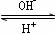 R(OH)3
R(OH)3 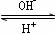 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为 。
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键
25.(15分)
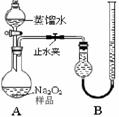 某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究。
[实验一] 取样品0. 100 g,用右图所示实验装置进行测定。
(夹持装置省略)
(1)检查装置A气密性的方法是
。
(2)若在实验过程中共产生气体11.20 mL(已折算成标准
状况),则样品中Na2O2的纯度为 。
[实验二] 样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250 mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到 。
(4)取上述所配溶液各25.00 mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
|
实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
标准盐酸体积(mL) |
23.00 |
24.98 |
25.00 |
25.02 |
由表中数据可知,标准盐酸体积的平均值为 mL。若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是 (填“偏高”、“偏低”或“无影响”)。
[实验分析] 实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小。经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因。查阅资料发现:Na2O2与水反应产生的H2O2未完全分解。
①写出Na2O2与水生成H2O2的化学方程式 。
②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
。
24.(16分)
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
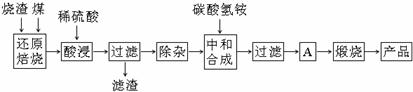
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
|
氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
|
完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
23.(14分)
 甲、乙、丙、丁四种物质转化关系如右图。已知甲是
甲、乙、丙、丁四种物质转化关系如右图。已知甲是
地壳中含量最高的元素组成的单质,化合物乙、丙、
丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是 ;
②丙溶液中通入少量CO2生成丁的离子方程式是 。
(2)若2乙(g) + 甲(g)  2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
|
温度/℃ |
400 |
450 |
500 |
550 |
600 |
650 |
|
转化率/% |
99.2 |
97.5 |
93.5 |
85.6 |
73.7 |
58.5 |
①该反应的△H 0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是 ;
②已知:R(s) + 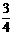 O2(g)
=
O2(g)
= 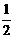 R2O3(s) △H=-834.8 kJ·mol -1
R2O3(s) △H=-834.8 kJ·mol -1
Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol -1
写出R的单质与MnO2反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com