
题目列表(包括答案和解析)
22.在8.08g铁与铜的混和物中,加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属5.44g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g。若硝酸的还原产物只有NO,下列说法正确的是( )
A.剩余的5.44g金属为铁 B.剩余5.44g 金属为铜
C.共生成NO气体 0.03mol D.8.08g金属中铁的质量分数为20.8%
第Ⅱ卷
21.测定Cu(NO3)2∙nH2O的结晶水含量,下列方案中不可行的是
A.称量样品→加热→冷却→称量CuO
B.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量
C.称量样品→加热→冷却→称量Cu(NO3)2
D.称量样品→加NaOH→过滤→加热→冷却→称量CuO
20.已知常温下反应①、②、③的平衡常数关系为K1> K3> K2,据此所做以下推测合理的是
①NH3+H+ NH4+
(平衡常数为K1) ②Ag++Cl-
NH4+
(平衡常数为K1) ②Ag++Cl- AgCl(平衡常数为K2)
AgCl(平衡常数为K2)
③Ag++2NH3 Ag(NH3)2+(平衡常数为K3)
Ag(NH3)2+(平衡常数为K3)
A.氯化银可溶于氨水 B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀 D.银氨溶液可在酸性条件下稳定存在
19.常温下,下列各组溶液中的离子一定能大量共存的是
A.酚酞呈无色的溶液中:K+、Al3+ 、Cl-、HCO3-
B.使pH试纸变深蓝色的溶液中:ClO-、Na+ 、AlO2- 、SO42-
C.甲基橙呈红色的溶液中: NH4+、I-、Fe2+、SO42-
D.加入铝粉产生氢气的溶液:Na+ 、SO42- 、Mg2+、NO3-
18.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
A.弱碱的浓度大于强酸的浓度 C.原氨水中有1%的含氮微粒为NH4+
B.反应后的溶液呈酸性 D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L
17.往含0.2 molNaOH和0.1 molBa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标况下)时立即停止,则在这一过程中,溶液中离子总的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
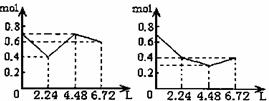
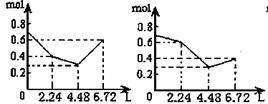
A B C D
16.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O → 2Fe2++SO42-+4H+ B.2Fe2++Cl2 → 2Fe3++2Cl-
C.I2+SO2+2H2O → H2SO4+2HI D.H2O2+H2SO4 → SO2+O2+2H2O
15. 右图实验为研究金属腐蚀的实验。下列相关说法正确的是
右图实验为研究金属腐蚀的实验。下列相关说法正确的是
A.食盐水中有气泡逸出
B.铁表面的反应为Fe -3e→Fe3+
C.红色首先在食盐水滴的中心出现
D.该实验研究的是金属的吸氧腐蚀
14.NA表示阿伏伽德罗常数,下列判断正确的是
A.在20g D2O中含有NA个氧原子
B.标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA
C.1 molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L
13.下列实验不能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定等浓度的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com