
题目列表(包括答案和解析)
31.空燃比是指汽车发动机中燃烧1kg燃料消耗的空气质量(kg),它是影响汽车尾气污染物含量的最基本因素。而理想空燃比是指燃料与氧气恰好完全燃烧时的1kg燃料所消耗空气的质量。回答下列问题(为简化计算,设汽油的成分为辛烷(C8H18),空气中只含有氮气和氧气,氧气在空气中的体积百分含量为20%):
(1)氧气在空气中的质量百分含量为____________(计算结果取三位有效数字,下同);
(2)计算该燃料的理想空燃比___________;
(3)若燃烧过程中除CO2外,还有CO生成,说明实际空燃比________(填“>”、“<”、“=”)理想空燃比。若产物中CO与CO2的体积比为1:7,计算实际空燃比;
(4)若燃烧产生的尾气冷却后,测得其中CO的体积分数为x,计算:
①燃烧1mol燃料生成CO 的物质的量a(用x表示);
②实际空燃比y(用x表示)。
30.“侯氏制碱法”的发明为振兴中国化工工业做出了重要贡献。制碱法的第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为:
NaCl + CO2 + NH3 + H2O → NaHCO3↓+ NH4Cl
|
|
NaCl |
NaHCO3 |
NH4Cl |
|
10℃ |
35.8 |
8.15 |
33.0 |
|
45℃ |
37.0 |
14.0 |
50.0 |
现在45℃时,取117g食盐配制成饱和溶液,向其中通入适量氨气后,再向其中通入二氧化碳,使反应进行完全。试计算并回答下列问题(计算结果取三位有效数字)(有关物质的溶解度数据如右表,单位:g/100g水)。
(1)117g食盐理论上可以制取纯碱________________ g;
(2)45℃反应完毕后,有晶体析出,计算析出晶体的质量。
(3)过滤除去析出的晶体后再降温至10℃,又有晶体析出,计算所析出晶体的质量。
29.化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物F。
已知: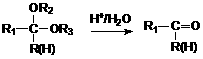
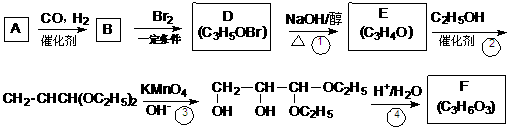
回答下列问题;
(1)写出下列物质的结构简式:
A: ;B: ;F: ;
(2)指出反应类型:B→D ,反应①____________;
(3)E可与新制的Cu(OH)2反应,写出化学方程式________________________;
(4)写出反应D→E的化学方程式 ;
(5)用E制取F,必须经过反应②③④,其中反应②④的目的是 ;
(6)化合物G是F的一种同分异构体,G在浓硫酸存在的条件下加热,可生成六原子环状化合物,写出G生成高分子化合物(C3H4O2)n的化学方程式__________。
28.双环戊二烯( )是一种化学活性很高的烃,存在于煤焦油中。
)是一种化学活性很高的烃,存在于煤焦油中。
(1)写出双环戊二烯的分子式______________;
(2)双环戊二烯的各种同分异构体中,可能含有的官能团有__________
a.碳碳双键 b.碳碳叁键 c.苯环
(3)室温下发生下列反应: ,反应类型为_______;该反应的产物除
,反应类型为_______;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式___________;
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式___________;
(4)篮烷(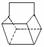 )是双环戊二烯的一种同分异构体,它的一氯代物有_________种。
)是双环戊二烯的一种同分异构体,它的一氯代物有_________种。
27.无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如下图所示。铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表)。


|
|
开始 |
完全 |
|
Fe2+ |
7.6 |
9.7 |
|
Fe3+ |
2.7 |
3.7 |
|
Al3+ |
3.3 |
5.0 |
|
Mn2+ |
8.3 |
9.8 |
(1) 试剂X可以用下列试剂中的__________(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是__________________;
(3)操作I的名称__________________;
(4)除铁时,必须先加入高锰酸钾溶液,目的是_____________________;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式____________________;
(5)滤渣的含铁成分是__________,用离子方程式表示其成因____________________;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用____________。
26.我国的市售加碘食用盐中的添加剂为碘酸钾(KIO3)。碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
(1)在实验室检验某食用盐是否加碘盐,必须用到的试剂是____(填入编号)
a.碘化钾 b.稀硫酸 c.淀粉溶液 d.苯
(2)向上述反应生成的碘溶液中加入四氯化碳,实验现象为__________________________;
(3)Na2SO3可以还原I2,某学生设计利用Na2SO3回收上述实验中的四氯化碳,操作步骤为:①将碘的四氯化碳溶液置于分液漏斗中、②检漏、③分离出下层液体、④振荡、⑤静置、⑥加入适量Na2SO3稀溶液,正确的操作顺序是_________________(填编号),用到的主要玻璃仪器为____________________;
(4)某学生欲利用反应:I2+2S2O32 - → 2I-+S4O62 -测定加碘盐的碘含量,设计实验步骤为:


滴定时取20.0mL待测液,消耗2.0×10-3 mol/L的Na2S2O3溶液10.0 mL。
①滴定以淀粉溶液为指示剂,显示滴定至恰好完全反应的现象是_______________;
②所测精制盐的碘含量是(以含w的代数式表示)_________________mg/kg;
(5)日本福岛核泄漏事件引起“抢购盐”风波。按国家标准,加碘盐中碘含量为20~25mg/1kg。为治疗辐射,成年人每日需摄入碘130mg,若这些碘都来自加碘盐,则成年人每日至少需摄入的食盐质量为____________。
25.用化学平衡理论研究2NO2 N2O4的反应体系,对硝酸的工业生产有现实意义。图a和图b分别表示密闭容器中不同条件下该反应体系的化学平衡的情况。
N2O4的反应体系,对硝酸的工业生产有现实意义。图a和图b分别表示密闭容器中不同条件下该反应体系的化学平衡的情况。
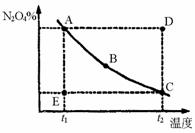

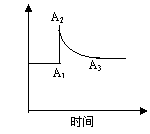
(图a) (图b)
(1)该反应的平衡常数表达式为K=,在密闭容器中,当其他条件不变的情况下,向已平衡的反应体系中充入N2O4,K_____(填“变大”、“变小”、“不变”),平衡向_____方向移动;
(2)图a表示恒温条件下快速压缩容器,体系中c(NO2)的变化情况。由A1→A2,c(NO2)变化的原因是______________,由A2→A3,c(NO2)变化的原因是_________;
(3)图b表示在恒压条件下平衡体系中N2O4的质量分数随温度的变化情况(实线上的任何一点为对应温度下的平衡状态)
①A、B、C、D、E各状态时,v正>v逆的是_______;
②维持t1不变,E→A所需时间为x,维持t2不变,D→C所需时间为y,则x____y(<、>或=);
(4)工业上制硝酸时,常将NO2转化为液态N2O4后与水反应,以提高硝酸产率。欲实现该转化,较为适宜的条件是________________。
24.多硫化钠Na2Sx( )在结构上与Na2O2有相似之处,是具有广泛用途的化学试剂。
)在结构上与Na2O2有相似之处,是具有广泛用途的化学试剂。
(1)在碱性溶液中,将NaClO与Na2Sx混合,两者分别发生下列变化:
NaClO → NaCl, Na2Sx →Na2SO4
其中发生氧化反应的是_____________,氧化剂是______________;
若x =2,则NaClO与Na2Sx的物质的量之比为_________________;
(2)以硫粉(S)为原料制备Na2Sx,反应体系中除了Na2Sx、S外,还有NaOH、Na2SO3、H2O三种物质。若x=5,完成下列化学方程式并配平

 S +
S + 
 __________ →
__________ →

 Na2S5 +
Na2S5 + 
 ____________
+
____________
+ 
 ____________
____________
23.电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是 (用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是 (用元素符号表示);
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态 ;氧元素原子核外有 种不同能级的电子;
(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B-F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;
(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
22.在8.08g铁与铜的混和物中,加入200mL、0.6mol/L的稀硝酸,充分反应后剩余金属5.44g,再向其中加入50mL、0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g。若硝酸的还原产物只有NO,下列说法正确的是( )
A.剩余的5.44g金属为铁 B.剩余5.44g 金属为铜
C.共生成NO气体 0.03mol D.8.08g金属中铁的质量分数为20.8%
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com