
题目列表(包括答案和解析)
18.(14分)盐酸卡布特罗是一种用于治疗支气管的药物,其合成路线如下:
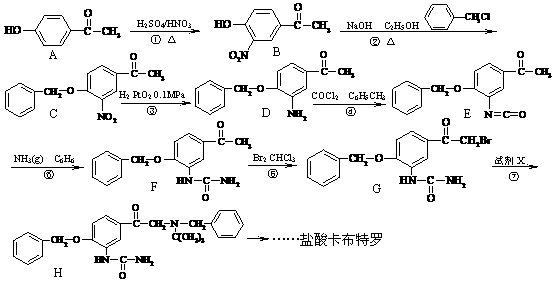
(1)上述的转化反应中,原子利用率100%的反应是第 ▲ 步(填写反应序号)。
(2)反应②的类型为 ▲ ;试剂X的分子式为 ▲ 。
(3)A分子与H2完全反应生成的分子内有 ▲ 个手性碳原子。
(4)B的同分异构体有多种,其中同时满足下列条件的同分异构体的数目有 ▲ 种。
① 苯环上有三取代基;② 能与FeCl3溶液发生显色反应;③ 能发生银镜反应; ④ 分子中含有硝基,且与苯环直接相连。
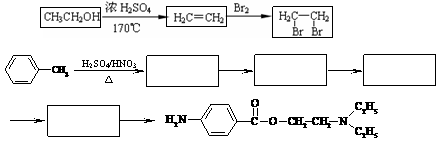
(5)试利用上述合成路线的相关信息,由甲苯、ClCH2CH2OH、(C2H5)2NH等合成普鲁卡因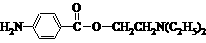 (无机试剂任用),完成下列流程图。
(无机试剂任用),完成下列流程图。
 合成路线流程图示例如下:
合成路线流程图示例如下:
17.( 12分)一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g)
该反应的ΔH ▲ 0
Ni(CO)4(g)
该反应的ΔH ▲ 0
(选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)金属氧化物被一氧化碳还原生成金属单质和二氧化碳。下图1是四种金属氧化
物被一氧化碳还原时lg[c(CO)/c(CO2)]与温度(t)的关系曲线图。则一氧化碳还原三氧化铬反应的化学平衡常数表达式可表示为:K= ▲ 。800℃时,其中最易被还原的金属氧化物是 ▲ (填化学式),该反应的平衡常数数值(K)等于 ▲ 。
(4)下图2是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极发生的电极反应式 ▲ 。
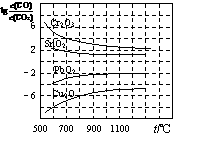
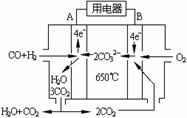
图1 图2
16.(8分)(CrO3)易溶于水、醇、硫酸和乙醚,不溶于丙酮。某工艺以铬酸钠为原料制备铬酸酐的流程如下:
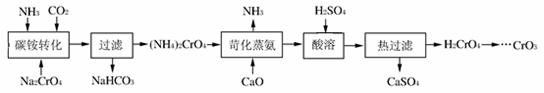
(1)在上述流程中可直接循环利用的物质有: ▲ 。
(2)“苛化蒸氨”的化学方程式 ▲ 。
(3)“热过滤”的原因可能是: ▲ 。
(4)含有硫酸、CrO3的硅胶可用于检测酒后驾车现象,其原理是:乙醇会被氧化生成乙醛,同时CrO3被还原为硫酸铬[Cr2(SO4)3],试写出反应的化学方程式
▲ 。
15.(10分)工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2•2H2O)的生产流程如下:
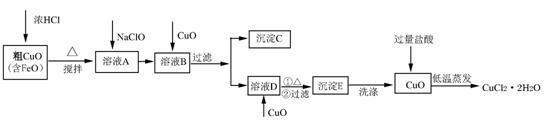
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
完全沉淀时的pH |
≥9.6 |
≥6.4 |
3~4 |
(1)写出向溶液A中加入NaClO的离子方程式 ▲ 。
(2)沉淀C的化学式为 ▲ 。
(3)实验室如何检验沉淀E已洗涤干净? ▲ 。
(4)低温蒸发的目的是 ▲ 。
(5)流程中两次加入了CuO,而不是一次性向溶液B中加入过量的CuO,其理由是
▲ 。
14.

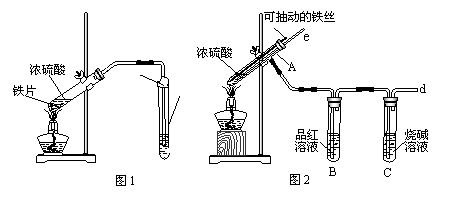 (14分)某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
(14分)某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
(1)比较两实验装置,图2装置的优点是:
①能更好的吸收有毒气体SO2,防止其污染环境;
② ▲ 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 ▲ 。
(3)能说明有SO2气体产生的实验现象是 ▲ 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液 B.稀H2SO4硫酸 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的 ▲ (填试剂序号,下同),振荡,再滴加少量的 ▲ ,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1. 取试样,滴加少量的 ▲ (填试剂序号),溶液的颜色变 ▲ 色
则试样中含有Fe3+,发生反应的离子方程式为 ▲ 。
步骤2. 再取适量的试样滴加到少量的 ▲ (填试剂序号),溶液的颜色变为 ▲ 色,则试样中含有Fe2+。
13.2.8gFe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是
A.反应前HNO3溶液的浓度为1.0mol·L-1 B.1.12L气体是NO、NO2的混合气体
C.反应后溶液中c(NO3-)=0.85mol·L-1 D.反应后的溶液最多还能溶解1.82gFe
非选择题(80分)
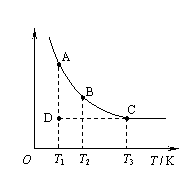
12.实验室中配制碘水,往往是将I2溶于KI溶液中,
即可得到浓度较大的碘水,原因是发生了反应:
I2(aq)+I-(aq)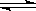 I3-(aq)。在上述反应的平衡体系中,
I3-(aq)。在上述反应的平衡体系中,
I3-的物质的量浓度c(I3-)与温度T的关系如右
图所示(曲线上的任何一点都表示平衡状态)。
下列说法正确的是
A.该反应的正反应为放热反应
B.A状态与C状态的化学反应速率比较为v(A)>v(C)
C.在T1、D状态时,v正<v逆
D.由I2(aq)+I-(aq)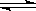 I3-(aq)推知,欲配制浓度较大的氯水,将氯气通入氯化钾溶液即可
I3-(aq)推知,欲配制浓度较大的氯水,将氯气通入氯化钾溶液即可
11.X、Y、Z、W、R属于短周期元素。已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2︰1。 下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R> W> Z
 D.Y分别与Z、W、R以两种元素组成的常见化合物有5种
D.Y分别与Z、W、R以两种元素组成的常见化合物有5种
10.下列溶液中微粒的物质的量浓度关系正确的是
A.pH=2的HNO3溶液与pH=12的NH3·H2O溶液等体积混合:
c(NH4+)+c(H+)=c(OH-)+c(NO3-)
B.浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:
2c(Na+)=3[c(CO32-)+c(HCO3-)]
C.25℃时,浓度均为0.1 mol·L-1的NH3·H2O、NH4Cl溶液等体积混合,所得溶液显碱性:c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-)
D.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:
c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
9.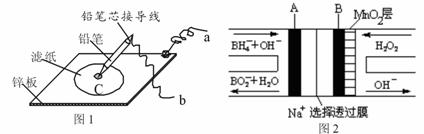 图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列说法正确的是
图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池,则下列说法正确的是
A.图2电池放电过程中,Na+从正极区向负极区迁移
B.图2电池负极区的电极反应为BH4-― 8e- + 8OH-=BO2- + 6H2O
C.若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com