
题目列表(包括答案和解析)
12.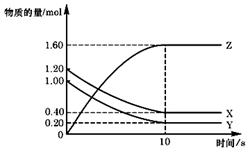 T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,
下列描述正确的是( )
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为4 L,平衡向逆反应方向移动
C.T ℃时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率为60%
D.T ℃时,该反应的化学方程式为:X(g)+Y(g)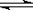 2Z(g),平衡常数K= 40
2Z(g),平衡常数K= 40
11.下表选项中对规定反应的离子方程式的评价合理的是 ( )
|
选项 |
反应 |
离子方程式 |
评价 |
|
A |
FeI2和Cl2以5:7的物质的量比反应 |
4Fe2++10I一+7Cl2=4Fe3++5I2+14CI一 |
正确 |
|
B |
碳酸氢钠溶液与足量 的氢氧化钡溶液反应 |
Ba2++20H一+2HC03=BaC03↓+C032-+2H20 |
正确 |
|
C |
金属Na和CuS04溶 液反应 |
Na+Cu2+=Na++Cu |
错误。离子方程式不 符合电荷守恒原则 |
|
D |
过量二氧化碳通入次 氯酸钙溶液中反应 |
2C10一+H20+C02=2HCl0+CO32- |
错误。生成物碳酸钙 不应写成离子形式 |
10.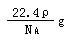 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,密度为ρg•L-1的某气体纯净物一个分子的质量为
B.17g甲基(-14CH3)所含电子数为7NA
C.1mol C6H14分子中共价键总数为20 NA
D.常温下,0.2molCl2溶于等体积水中,转移电子数为0.2 NA
9. 2010年世博会上,俗称“紫蚕岛”的日本馆顶部采用了一种名为EFTE(乙烯一四氟乙烯共聚物)的淡紫色膜材料。它有最大程度的透光性,膨胀后的枕头状内部通过非晶体太阳能电池可以完成内部发电。根据所学的化学知识判断有关EFTE膜材料的说法错误的是( )
A.EFTE没有固定的熔沸点
B.EFTE是由乙烯和四氟乙烯两种单体经过加聚反应生成,而不是直接混合而成的
C.EFTE结构中含有碳碳双键,可以使溴的四氯化碳溶液褪色
D.EFTE具有高抗污,易清洗等优点
8.根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离
子都是碱。按照这个理论,下列微粒属于两性物质的是( )
①HS- ② ③
③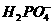 ④NH3 ⑤H2S
⑥CH3COOH
④NH3 ⑤H2S
⑥CH3COOH
⑦OH-
⑧H2O ⑨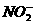 ⑩
⑩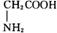
A.①⑤ B.③⑥ C.①②⑨ D.①③⑧⑩
7.生活中的化学无处不在,根据所学的化学知识判断下列说法错误的是( )
A.去年以来,我国北方多省市遭遇严重干旱,气象部门密切监视天气变化,抓住有利
天气时机组织开展人工增雨(雪)作业。干冰和碘化银都可用于人工增雨(雪)
B.新装修的房屋不宜立即入住,因为装修材料会释放出对人体有害的甲醛等气体
C.卫生部公告201 1年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在
食品中使用任何食品添加剂
D.车用乙醇汽油的推广使用不仅可以减少环境污染,还可以缓解我国石油短缺的局面,
将成为我国可持续发展的一项长期战略
20.B(12分)硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4―+8H+ = 5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 ▲ (填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是 ▲ 。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
(3)某同学设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
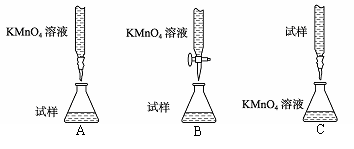
方案二 重量法 操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是 ▲ 。
(5)步骤②是否可以省略 ▲ ,理由是 ▲ 。
(6)步骤④中一系列操作依次是:过滤、洗涤、 ▲ 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 ▲ g(用含a的代数式表示)。
20.A(12分)第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大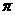 键,C6H6是非极性分子
键,C6H6是非极性分子
 D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
|
元 素 |
Mn |
Fe |
|
|
电离能 /kJ·mol-1 |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
Mn元素价电子排布式为 ▲ ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 ▲ 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 ▲ 区。
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为 ▲ 。
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
① H、C、N、O四种元素的电负性由小到大的顺序为 ▲ 。
② 与CNO-互为等电子体微粒的化学式为 ▲ (写出一种即可)。
③ 氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 ▲ 。
20.选做题 共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
19.(10分)某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
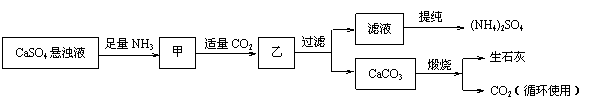
已知:Ksp(CaCO3)=2.8×10―9 ,硫酸钙悬浊液中CaSO4136kg•m―3,生产过程中CO2的利用率为90%,并测得滤液中c(CO32―)为0.001 mol•L―1。
(1)甲中通入CO2后发生反应的方程式为: ▲ 。
(2)求Ksp(CaSO4) = ▲ (忽略溶液体积变化)。
(3)若每天用1000 m3的悬浊液,试计算:
① 可生产纯度为95%的(NH4)2SO4多少吨?
② 还需要补充含90%CaCO3的大理石多少吨?(计算结果保留一位小数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com