
题目列表(包括答案和解析)
8.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是
A.Mg2+、Na+、SO42-、Cl- B.K+、CO32-、Cl-、NO3-
C.Na+、K+、NO3-、SO32- D.NH4+、Na+、SO42-、NO3-
7. 日本地震后引发的核泄漏放射物中含有放射性核素碘-131,下列有关
的说法正确的是
日本地震后引发的核泄漏放射物中含有放射性核素碘-131,下列有关
的说法正确的是

 A.
互为同素异形体
B.
互为同位素
A.
互为同素异形体
B.
互为同位素

 C. 分别含有78和81个质子 D.
都含有78个中子
C. 分别含有78和81个质子 D.
都含有78个中子
38.[化学--选修有机化学基础](15分)
X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1 mol X水解得到1 mol Y和1 mol CH3CH2OH, X、Y的相对分子质量都不超过200,完全燃烧都只生成C02和H20。且X分子中碳和氢元素总的质量百分含量约为 81.8%。
(1)X、Y相对分子质量之差为_____________________。
⑵1个Y分子中应该有_____________个氧原子。
⑶X的分子式是___________________________________
⑷G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
|
|
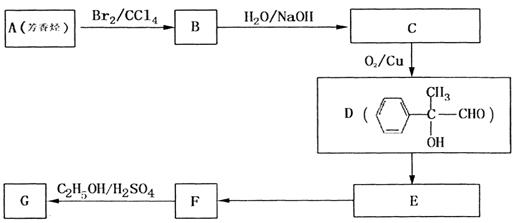
①写出A的结构简式_____________________
②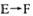 的反应类型是______________反应,该反应的化学方程式为:______________________。
的反应类型是______________反应,该反应的化学方程式为:______________________。
③写出所有符合下列条件的F的同分异构体的结构简式:______________。
i .分子内除了苯环无其他环状结构,且苯环上有2个对位取代基。
ii. 一定条件下该物质既能与银氨溶液发生银镜反应又能和FeCl3溶液发生显色反应。
37.[化学--选修物质结构与性质](15分)
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填高或低),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
 (4)F的核外电子排布式是
,F的高价离子与A的简单氢化物形成的配离子的化学式为
.
(4)F的核外电子排布式是
,F的高价离子与A的简单氢化物形成的配离子的化学式为
.
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式
为 ;(黑色球表示F原子)
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无
机非金属材料,其晶体中所含的化学键类型为 。
3.6×105kJ能量。通过计算判断,若反应:SO2(g)+1/2O2(g)=SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出) 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
|
沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
|
矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
36.[化学--选修化学与技术](15分)
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗
28.(15分)某化学学习小组对铝与酸和碱的反应进行探究,过程如下。
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的 (填写相应的字母);
a. 盐酸的物质的量浓度大于硫酸的物质的量浓度
b. Cl-能促进此反应的进行
c. SO42-能抑制此反应的进行
d. 硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分。
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸。
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的 (填写相应的试剂,下同),再向其中的一支试管中加入适量的 固体,并振荡使固体溶解,观察实验现象。
实验探究:略。
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者 后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为 ;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的。
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物。
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
① 向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解。实验时发现固体完全溶解,证明猜想 一定不正确(填“1”、“2”、“3”、“4”)。
② 向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解。实验时发现固体完全溶解,证明猜想 一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想 (填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:
27.(14分)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,D的焰色为黄色,C和G混合冒白烟并生成A
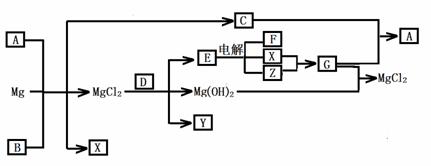
(1)写出下列物质的化学式
A Y
(2)写出C的电子式
(3)写出MgCl2与D反应的化学方程式
(4)请用电离或水解平衡解释A+B+Mg→C+X+ MgCl2的原因
。
(5)将1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如下图所示
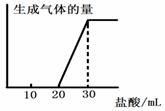 则原F溶液的浓度为 mol/L。
则原F溶液的浓度为 mol/L。
26.(14分)现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和,D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)元素B在周期表中的位置是 。
(2)C、D最低价氢化物稳定性的强弱顺序是 (填化学式) ;D、E、F原子半径的大小顺序是 (填元素符号)。
(3)在A、C、D组成的化合物中,既有离子键又有共价键的是 (填化学式)。
(4)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是 。
(5)化合物BA4D与O2、稀硫酸可组成燃料电池,此电池的负极反应式是 。
(6)在一定条件下,若有2.2kgBD2与足量A2恰好完全反应,生成气态的A2D和气态的BA4D,可放出2473.5kJ的热量,试写出该条件下发生反应的热化学方程式 。
13.下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO===4Mg2++NH+3H2O
B.25℃时,将20mL 0.1mol·L-1H2SO4溶液和30mL 0.15mol·L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10mL 0.1mol·L-1KAl(SO4)2溶液和10mL 0.2mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2
D.浓度均为0.1mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:
c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com