
题目列表(包括答案和解析)
31.(16分)
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。请填写下列空白:
(1)二甲醚、空气、氢氧化钾溶液多孔石墨电极可构成燃料电池。该电池中负极的电极反应式是:CH3OCH3+16OH–-12e– = 2CO32 –+11H2O,则正极的电极反应式是:
____________________________ ___。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g) ΔH=a kJ·mol–1
CH3OH(g) ΔH=a kJ·mol–1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH=b kJ·mol–1
CH3OCH3(g) + H2O(g) ΔH=b kJ·mol–1
③ CO(g) + H2O(g)  CO2(g) + H2(g)
ΔH=ckJ·mol–1
CO2(g) + H2(g)
ΔH=ckJ·mol–1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g)
+ CO2 (g)的ΔH= __________ kJ·mol–1。
CH3OCH3(g)
+ CO2 (g)的ΔH= __________ kJ·mol–1。
(3) 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L–1) |
0.64 |
0.50 |
0.50 |
①比较此时正、逆反应速率的大小:v(正) ______ v(逆)(填“>”、“<”或“=”),
简述原因
。
② 若开始只加入CH3OH,经10min后反应达到平衡,平衡时CH3OH转化率
α(CH3OH) = _______ ___(计算结果保留小数后一位)。
30.(16分)从有机物A开始有如图所示的转化关系(部分产物略去)。A在NaOH溶液中水解生成B、C和D,1molF与足量的新制Cu(OH)2碱性悬浊液加热充分反应可生成2mol红色沉淀。分析并回答问题:
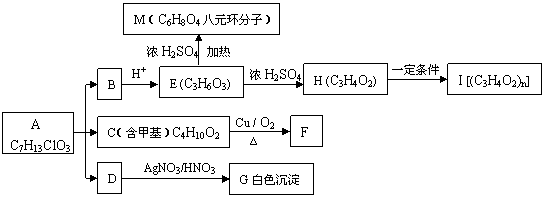
(1)A中含有的官能团为氯原子(-Cl)和 、 。
(2)指出反应类型:

 A B、C、D
; H I
。
A B、C、D
; H I
。
(3)写出下列反应的化学方程式:
 ①C F
。
①C F
。
 ②E H:
。
②E H:
。
23.已知25℃时有关弱酸的电离平衡常数:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与amol·L-1 NaOH溶液等体积混合后,测得所得溶液显碱性
(pH>7),则c(OH–)>c(H+),c(Na+)>c(CN–)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
22. 右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,正确的是
右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,正确的是
A.D单质在过量的B2中燃烧的主要产物为DB3
B.C的氢化物比E的氢化物稳定
C.A与B形成的阴离子可能有:AB32–、A2B42–
D.工业上常将E单质通入澄清石灰水中制漂白粉
12.下列实验操作与预期的实验目的或结论均正确的是
|
选项 |
实验操作 |
预期的实验目的或结论 |
|
A |
对某白色固体进行焰色反应实验,火焰呈黄色 |
该物质含钠元素 |
|
B |
将SO2气体通入某红色溶液中,溶液褪色 |
该溶液一定为品红溶液 |
|
C |
蔗糖溶液中加入少量稀硫酸、加热,然后加入银氨溶液再加热 |
验证蔗糖在强酸性条件下是否发生水解 |
|
D |
除去苯中混有的少量苯酚 |
加入浓溴水后过滤 |
11.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1mol乙基(-C2H5)中含有的电子数为17NA
B.标准状况下,22.4L氯仿(三氯甲烷)中共价键数目为4NA
C.1L pH=1的稀硫酸中有0.2 NA个H+
D.78gNa2O2中含有2NA个阴离子(相对原子质量:Na-23 O-16)
10.下列离子方程式表达正确的是
A.Fe(OH)3溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
B.碳酸氢钠溶液与过量澄清石灰水反应:HCO3–+Ca2++OH–=CaCO3↓+H2O
C.硫酸亚铁溶液中加入酸化的双氧水:Fe2+ + 2H+ + H2O2 = Fe3+ + 2H2O
D.向明矾溶液中滴加过量氨水:Al3++4NH3·H2O == AlO2–+4NH4++2H2O
9.下列各组离子在给定条件下,能大量共存的是
A.含有NO3–的水溶液中:NH4+、Fe2+、SO 42– 、H+
B.在pH=2的溶液中:ClO–、SO32–、Na+ 、K+
C.含有CO32–的澄清透明溶液中:K+、C6H5O–、Cl–、Na+
D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO– 、I–
8.科学家合成了一系列独特的氢铝化合物。最简单的氢铝化合物化学式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法不正确的是
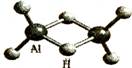 A.Al2H6中Al为-3价, H为+l价
A.Al2H6中Al为-3价, H为+l价
B.Al2H6在空气中完全燃烧,产物为氧化铝和水
C.Al2H6是共价化合物
D.氢铝化合物可能成为未来的储氢材料和火箭燃料
7.在2010年上海世博会上,清洁能源、低碳经济、节能减排等理念得到了充分体现。下列做法中不能体现上述理念的是
A.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能
B.快餐盒用生物质材料“玉米塑料”(主要成分为可降解聚乳酸)做成
C.使用的卫生纸都是再生纸
D.把世博会期间产生的垃圾焚烧或深埋处理
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com