
题目列表(包括答案和解析)
(一)必考题(11题,共129分)
26.(14分)
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
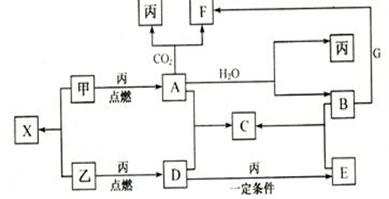
(1)写出C的化学式_____________;G的俗称_________;A的电子式_______
(2)写出A与H2O反应的离子方程式:____________________________________。
(3)写出F溶液通入CO2的离子方程式:__________________________________。
(4)写出D→E的化学方程式:___________________________________________。
(5)写出B与G生成F反应的离子方程式:_______________________________
|
Na2SO3(s)+ H2SO4(85%)== Na2SO4 + H2O + SO2↑
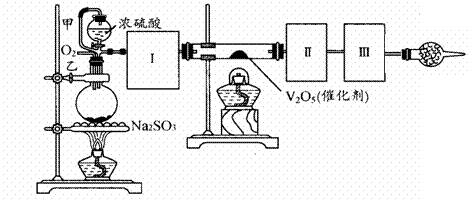
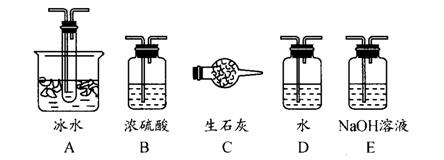
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A-E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 _____ 、 _____ 、
_______ 。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因 ,验证方法
②原因 ,验证方法
③原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
28.(15分)二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0-10.0Mpa,温度230-280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO
C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=
;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H=
;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(4)二甲醚的燃烧热为1455 kJ·mol-1,则二甲醚燃烧的热化学方程式为 。
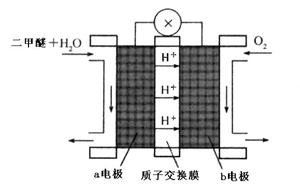
(5)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是 极,写出a电极上发生的电极反应式 。
13.下列实验操作不能达到其对应目的的是 ( )
|
编号 |
实验操作 |
目的 |
|
A |
取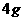  加入96mL水中 加入96mL水中(水的密度近似看作1g/ 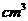 ) ) |
配置4% 溶液 溶液 |
|
B |
滴定实验中,用待测液润洗锥形瓶 |
避免造成误差使滴定结果偏低 |
|
C |
向 溶液中滴入酚酞溶液,加热 溶液中滴入酚酞溶液,加热 |
证明升高温度能促进 水解 水解 |
|
D |
向盛有铜片的试管中加入浓硫酸,加热 |
证明浓硫酸具有强氧化性 |
12.下列说法中正确的是 ( )
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色
C.甲苯中所有原子都处于同一平面
D.相同质量的甲烷和乙烷完全燃烧乙烷耗氧量多
11.下列离子方程式书写正确的是 ( )
A.向50 mL 1 mol·L-1明矾溶液中滴入数滴0.1 mol·L-1Ba(OH)2溶液
Al3++2SO42-+2Ba2++3OH- === Al(OH)3↓+2BaSO4↓
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I- === 3I2+2H2O
C.a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2 = Br2+2Fe3++4C1-
D.在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++ OH-+ HCO3- == CaCO3↓+H2O
10.25℃时,下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.等物质的量浓度的H2S和NaHS混合溶液中:
c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.pH =3的一元酸HA与pH=11的NaOH溶液等体积混合后:
c(Na+)>c(A-)>c(OH-)>c(H+)
D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合后pH=9:
c(NH+4)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
9. 在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生如下反应:
A(s)+2B(g) C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2
mol·L-1。
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2
mol·L-1。
下列叙述不正确的是 ( )
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.5 min时,容器内D的浓度为0.2mol·L-1
C.当容器内压强保持恒定时,该可逆反应达到平衡状态
D.5 min时容器内气体总的物质的量为3 mol
8.下列除去杂质的方法正确的是 ( )
( )
① 除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
② 除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、蒸馏;
③ 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④ 除去乙醇中少量的乙酸:加足量生石灰,蒸馏。
A.① ② B.② ④ C.③ ④ D.② ③
7.化学与生产、生活、社会密切相关。下列有关说法中,错误的是 ( )
A.利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D. 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性
33.(16分)纯碱、烧碱等是重要的化工原料。
 (1)利用右下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,反应的离子方程式是______
_。
(1)利用右下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,反应的离子方程式是______
_。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,充分反应后将溶液在一定条件下蒸发结晶,得到少量的白色固体。试设计实验确认该白色固体的成分。
①提出合理假设。
假设1:该白色固体为NaOH和Na2CO3;
假设2:该白色固体为只有Na2CO3;
假设3:该白色固体为只有NaHCO3;
假设4:该白色固体为________ ____。
②基于假设1,设计实验方案进行实验证明固体的成分是NaOH和Na2CO3。请在答题卡上写出实验步骤及预期现象和结论。(步骤可不填满也可增加)
限选实验试剂及仪器: 1moL·L–1HCl溶液、1mol·L–1 MgCl2溶液、0.5moL·L–1BaCl2溶液、1mol·L–1 Ba(OH)2溶液、甲基橙试液、酚酞试液、试管、胶头滴管、过滤装置。
|
实验步骤 |
预期现象和结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
32.(16分)
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。干法、湿法制备高铁酸盐的原理如下表所示。
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
|
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH=====2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
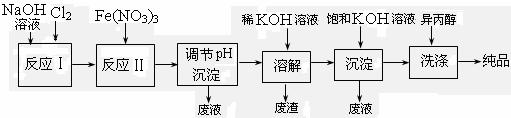
(2) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
①反应I的离子方程式为 。
②反应II的化学方程式为 。
③加入饱和KOH溶液的目的是 。
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为 ,它能净水的原因是
 ____ 。
____ 。
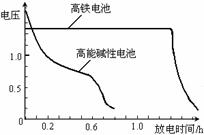
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com