
题目列表(包括答案和解析)
19.(14分)组蛋白去乙酰化酶( HDAC)抑制剂能激活抑癌基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡。下面是一种HDAC抑制剂(F)的合成路线:

已知①同一个碳原子上连接2个羟基的结构不稳定,会失去一个水分子
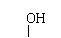
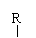
 ②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO
②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO
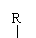 ③R-CH2-CH=O + R-CH-CHO
③R-CH2-CH=O + R-CH-CHO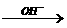 R-CH2-CH-CH-CHO
R-CH2-CH-CH-CHO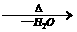
R-CH2-CH=C-CHO
(1)写出A转化为B的化学方程式 ▲ 。
(2)写出E中2种含氧官能团的名称 ▲ 。
(3)B到C的转化过程中,还生成一种小分子,其分子式为 ▲ 。
(4)写出D的结构简式 ▲ 。
(5)写出符合下列条件的B的同分异构体的结构简式
a.苯环上有3个互为间位的取代基,且有一个为甲基;
b.能与FeCl3溶液发生显色反应;
 c.不能发生银镜反应,但水解产物能发生银镜反应。
c.不能发生银镜反应,但水解产物能发生银镜反应。
(6)写出以对甲基苯酚(CH3- -OH,)和乙炔为主要原料制备化合物A的合成路线流程图
(无机试剂任选)。合成路线流程图示例如下:
 CH3CH2OH
CH3CH2OH CH2=CH2
CH2=CH2 CH2 - CH2
CH2 - CH2
▲
18.(12分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的
金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备
钼酸钠晶体的部分流程如下:
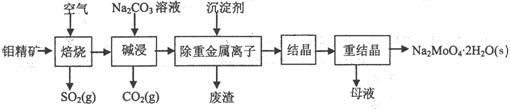
(1)写出“碱浸”反应的离子方程式: ▲
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是
▲ 。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,
Ksp(BaSO4)= 1.1×10-10、Ksp(BaMoO4)= 4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
▲ 。
 (4)右图是碳钢在3种不同介质
(4)右图是碳钢在3种不同介质
中的腐蚀速率实验结果:
|
蚀速率随酸的浓度变化有
明显差异,其原因可能是
▲ 。
②空气中钼酸盐对碳钢的
缓蚀原理是在钢铁表面形
成FeMoO4-Fe2O3保护膜。
密闭式循环冷却水系统中
的碳钢管道缓蚀,除需加入
钼酸盐外还需加入NaNO2。NaNO2的作用是 ▲
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量
浓度为 ▲ 。
17.(10分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。 目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)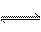 N2 (g)+CO2
(g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2
(g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
 浓度/mol·L-1 浓度/mol·L-1
|
NO |
N2 |
CO2 |
||
|
0 |
0. 100 |
0 |
0 |
||
|
10 |
0.058 |
0. 021 |
0. 021 |
||
|
20 |
0. 040 |
0.030 |
0.030 |
||
|
30 |
0.040 |
0.030 |
0.030 |
||
|
40 |
0.032 |
0. 034 |
0.017 |
||
|
50 |
0. 032 |
0. 034 |
0. 017 |
①T1℃时,该反应的平衡常数K= ▲ (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ▲ 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ▲ 0(填“>”、“=”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H= -574 kJ·mol-1
②CH4(g)+4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H= -1160 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
 写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 ▲
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 ▲
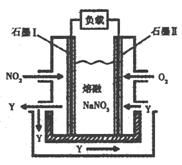
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在
使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应
可表示为 ▲
16.(10分)碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶,含少量硫酸钡、二氧化硅等不溶性杂质)为原料制取碳酸锶。其工艺流程如下:
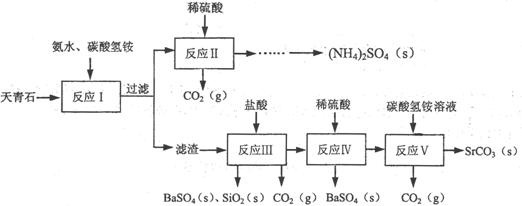
(已知:Ksp(SrSO4)=3.2×10-7、Ksp(SrCO3)=1.1×10-10、Ksp(BaSO4)= 1.1×10-10、Ksp(BaCO3)=5.1×10-9
(1)反应I中需将天青石粉碎,其目的是“ ▲ 。
(2)反应I在65-80℃进行,碳酸氢铵的用量大于理论量,其原因可能是 ▲ 。
(3)反应Ⅱ加硫酸的目的是 ▲ 。
(4)反应Ⅲ中除了SrCO3与盐酸反应外,发生的另一反应的离子方程式为 ▲ 。
(5)反应V中生成SrCO3的离子方程式为 ▲ 。
15.(12分)NaClO2用于棉、麻、粘胶纤维及织物的漂白。实验室制备NaClO2的装置如下图所示:
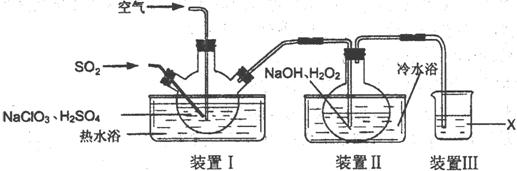
(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是 ▲ 。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为 ▲ 。反应后的溶液中阴离子除了ClO2-、
ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是 ▲ ,检验该离子的方法是
▲
(3)已知在NaClO2饱和溶液中温度低于38℃时析出晶体是NaClO2·3H2O,温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;② ▲ ;③ ▲ ;④ ▲ ;得到成品。
(4)装置Ⅲ中试剂X为 ▲ 。
14.向甲乙两个容积均为1L的恒容容器中,分别充入2 mol A、2molB和1 molA、1molB。相同条件下,发生下列反应:A(g) + B(g) xC(g) △H<O。测得两容器中c(A)随时间t的变化如图所示:
xC(g) △H<O。测得两容器中c(A)随时间t的变化如图所示:
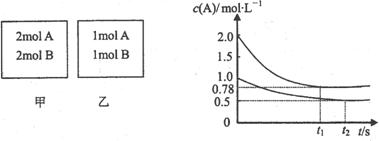
下列说法正确的是
A.x可能等于1也可能等于2
B.向平衡后的乙容器中充入氮气可使c(A)增大
C.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D.向甲容器中再充入2molA、2molB,平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
非选择题
13.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应的水化物均可由化合反应得到
D.高温条件下,A单质能置换出B单质,A单质也能置换出C单质
12.室温下,下列混合溶液中,各离子浓度的关系正确的是
A.pH=12的氨水与pH=2的盐酸等体积混合
c((Cl-)>c(NH4+)>c(OH-)>c(H+)
B.浓度均为0. 1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合
c(SO42-)>c(Na+))>c(NH4+)>c(H+)>c(OH-)
C.浓度均为0. 1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:
c(Na+)+c(H+) = 2c(CO32-) + c(OH-) + c(HCO3-)
D.浓度均为0. 1 mol·L-1的醋酸溶液与氢氧化钠溶液等体积混合
c(Na+) = c(CH3COO-)>c(OH-) =c(H+)
11.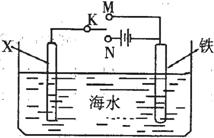 右图是模拟电化学反应装置图。下列说法正确的是
右图是模拟电化学反应装置图。下列说法正确的是
A.若X为碳棒,开关K置于N处,可以减缓铁的腐蚀
B.若X为碳棒,开关K置于M处、,则铁电极的电极反应式为:
Fe -3e- = Fe3+
C.若X为锌,开关K置于N处,则X极减少的质量与铁电极增加
的质量相等

D.若X为锌,开关K置于M处,则总反应方程式为:2Zn + O2 + 2H2O = 2Zn(OH)2
10.为达到预期的实验目的,下列操作中正确的是
A.欲鉴别FeCl2溶液、AlC13溶液和AgNO3溶液,向3种待测液中分别滴加足量氨水
B.欲检验蔗糖水解产物是否具有还原性,向水解后的溶液中加入新制氢氧化铜悬浊液并加热
C.欲除去乙烷气体中混有的乙烯,在Ni催化条件下通入氢气
D.欲除去苯中的苯酚,加入浓溴水后过滤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com