
题目列表(包括答案和解析)
8. 在一个V升的密闭容器中放入2升A(气)和1升B(气),在一定条件上发生下列反应:
3A(气)+B(气) → nC(气)+2D(气),达到平衡后,A的浓度减小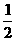 ,混合气体的平均分子
,混合气体的平均分子
量增大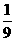 ,则该反应方程式中n值是( )
,则该反应方程式中n值是( )
(A) 1 (B) 2
(C) 3 (D) 4
7. 在N2 + 3H2 → 2NH3 的反应中,经过一段时间后,NH3的浓度增加了0.6摩/升,在此时
间内用H2表示的平均反应速度为0.45摩/(升·秒),所经过的时间是( )
(A) 0.44 秒 (B) 1 秒
(C) 1.33 秒 (D) 2 秒
6. 现在含有元素硒(Se)的保健品已开始进入市场,已知它与氧同主族,与钾同周期,
则下列关于硒的叙述中不正确的是( )
(A) 原子序数为24
(B) 最高价氧化物的分子式为SeO3
(C) 非金属性比溴弱
(D) 气态氢化物分子式为H2Se
5. 关于化学键的下列说法正确的是( )
(A) 离子晶体里只含离子键
(B) 共价化合物分子里一定不含离子键
(C) 非极性键只存在于双原子的单质分子里
(D) 不同元素组成的多原子分子里的化学键一定是极性键
4. 有X 和
和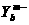 两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是
两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是
( )
(A) b-a=n+m (B) a-b=n+m
(C) 离子半径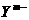 <
< 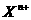 (D) 原子序数b>a
(D) 原子序数b>a
3. X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子数总比Y元素
原子的核外电子数总少5个。则X与Y可形成的化合物是( )
(A) 离子化合物 Y(XO3)2 (B) 离子化合物Y2X3
(C) 共价化合物Y3X2 (D) 共价化合物XY2
2. 在主族元素X、Y、Z中,X与Y两元素的原子核外电子层数相同; X的原子半径大于Y的原子半径,X与Z两原子的阳离子具有相同的电子结构,Z的离子半径大于X的离子半径,则X、Y、Z3种元素的原子序数最大的是( )
(A) X (B) Y
(C) Z (D) 无法判断
1. 同温同压下,等体积的两容器中,分别充满由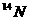 、
、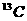 、
、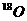 三种原子构成的一氧化
三种原子构成的一氧化
氮和一氧化碳。下列说法正确的是 ( )
(A) 所含分子数和质量均不相同
(B) 含有相同的质子和中子
(C) 含有相同的分子数和电子数
(D) 含有相同数目的中子、原子和分子
21. (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,请选择其中一题,并在相应的答题区域作答。若两题都做,则按A题评分。
A.核能源已日益成为当今世界的主要能源。
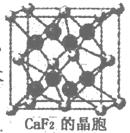
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2 (CO3)3]直接煅烧还
原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如右
图),则UO2晶体U4+的配位数为 ▲ ;

三碳酸铀酰铵中含有化学键类型有 ▲ ;
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
根据价层电子对互斥理论推测CO32-的空间构型为 ▲ ;写出一种与CO32-互为等电子体且属于非极性分子的微粒的化学式 ▲ 。
(2)为了获得高浓度的235U,科学家们采用“气体扩散法”:到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于 ▲ 晶体。’
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以作为核爆炸或核反应堆泄漏事故的信号核素。写出131I基态原子的价电子排布式 ▲ 。
 B.硝基苯酚是合成医药、染料、感光材料的中间体;以苯酚为原料制备硝基苯酚的步骤如下:
B.硝基苯酚是合成医药、染料、感光材料的中间体;以苯酚为原料制备硝基苯酚的步骤如下:
I.在常温下,向250 mL三口烧瓶中加试剂(加入的试剂有:A.50mL水;B.17.5gNaNO3;C.15mL浓硫酸)
Ⅱ.称取4.7 g苯酚,与1mL温水混合,并冷却至室温。
Ⅲ.在搅拌下,将苯酚水溶液自滴液漏斗滴入三口烧瓶中,将反应温度维持在20℃左右。
Ⅳ.加完苯酚后,继续搅拌1h,冷却至黑色油状物固化,倾出酸层。然后向油状物中加入20mL水并振摇,先倾出洗液,再用水洗三次,以除净残存的酸。。
V.邻硝基苯酚的提纯。固化的黑色油状物主要成分是邻硝基苯酚和对硝基苯酚。
|
|
密度 (g·mL-1) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
其他 |
|
邻硝基苯酚 |
1. 495 |
44. 45 |
214 |
微溶于冷水,易溶于热水 |
能与水蒸气一同挥发 |
|
对硝基苯酚 |
11. 481 |
113.4 |
279 |
稍溶于水 |
不与水蒸气一同挥发 |
(1)步骤I中加入试剂的先后顺序为 ▲ (填序号)
(2)苯酚有腐蚀性,步骤Ⅱ中若不慎使苯酚触及皮肤,应 ▲ 。苯酚中加少许水可降低熔点,使其中室温下即呈液态,这样操作的作用是 ▲ 。
(3)步骤Ⅲ中,将反应温度维持在20℃左右的原因是 ▲ 。
(4)步骤Ⅳ中,若黑色油状物未固化,则可用 ▲ (填实验仪器)将黑色油状物分出。
(5)根据题给信息,不使用温度计,设计步骤V得到纯净的邻硝基苯酚的实验方案; ▲ 。南京市2011届高三第三次模拟考试
20. (10分)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
(10分)氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的稀的路线如下:
(1)重结晶用10%-12%的硫酸作溶剂而不用水作溶剂的原因是 ▲
(2)“磺化”步骤中所发生的反应为:

①CO(NH2)2(s) + SO3(g)
 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H
+ H2SO4  2H2NSO3H
+ CO2↑
2H2NSO3H
+ CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是
▲ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g 产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25. 00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数。(请写出计算过程)
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有 ▲ 杂质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com