
题目列表(包括答案和解析)
5.298K时,向V升真空容器中通入n摩SO2和m摩H2S。若5n=m,且反应后氧化产物与还原产物的质量和为48克,则n与m之和为------------------------(C) A.1 B.2 C.3 D.4 [提示]:硫化氢过量1.5摩
4.工业上从含硒废料中提取硒的方法是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸即转化为亚硒酸(2HCl+H2SeO4 = H2SeO3+Cl2+H2O),再通入SO2于亚硒酸的溶液中,单质硒柝出,据此下列叙述正确的是------------------------------------------------------------------------------------------(AB)
A. H2SeO4的氧化性强于Cl2 B.亚硒酸的氧化性强于亚硫酸
C.SeO2还原性强于SO2 D.柝出1摩尔硒,1摩尔SO2
3.为除去SO2中混有的少量SO3,并使所得物质的平均分子量尽可能地增大,应选用的物质是----------------------------------------------------------------------------(D)
A.亚硫酸钠溶液 B.亚硫酸氢钠溶液 C.碱石灰 D.浓硫酸
[提示]:浓硫酸与SO3生成H2SO4·nSO3
2.用足量的氢气和氧气分别跟m克硫反应,并将生成物混和,可生成的硫为----------------------------------------------------------------------------------------------------(B)
A.2m克 B.1.5m克 C.m克 D.0.5m克
1.常温下,向20升真空容器中通入a摩尔硫化氢和b摩尔氯气(a和b都是正整数,且均小于或等于5),反应完全后,容器内气体可能达到的最在密度是-----(B)
A.19.45克/升 B.18.25克/升 C.17.85克/升 D.35.5克/升
[提示]:氯气在与硫化氢反应时,不管氯气过量与否,其中的氯元素始终存在于气体中,当氯化氢取最大值(b=5)时才符合题意,同时,考虑到与氯元素结合的氢越多,气体的质量也越大,密度值也越大,所以硫化氢在允许的前提下也是越大越好(a=5),可求得此时气体的密度为18.25克/升,答案为B。如果反过来考虑:硫化氢中的氢元素也始终存在于气体中,硫化氢理当取最大值,氯元素的量也应该最大,同样也可推得答案为B.[经计算,当a:b的值为1:5.45(不是正整数,不符合题意)时,为A; 当a:b的值为5:5时,为B; 当a:b的值为1:5时,为C; 当a:b的值为0:n时(此时不是混和气体,全是氯气,已不符合题意),气体的密度为17.75克/升,所以D是无论如何也达不到的.
5.
4.由CuS、Ag2O组成的黑色粉末中,已知氧的质量分数为4%,求此混和物中其它元素的质量分数、两物质的质量比及物质量之比。
[提示]:银的质量分数=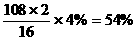 CuS的质量分数=1-(54%+4%)=42%
铜的质量分数=42%×
CuS的质量分数=1-(54%+4%)=42%
铜的质量分数=42%×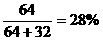 硫的质量分数=42%-28%=14%
CuS与Ag2S的质量比=21:29
CuS与Ag2S的物质量之比=7:4
硫的质量分数=42%-28%=14%
CuS与Ag2S的质量比=21:29
CuS与Ag2S的物质量之比=7:4
3.将一定量的氯酸钾和高锰酸钾的固体混和物充分加热,得到气体1792毫升(标准状)剩下固体经过必要的分离,所得的黑色难溶物质在强酸(浓硫酸)条件下,正好把分离出来的氯化物全部氧化(化学反应式可表示为MnO2+2KCl+4H2SO4
= 2KHSO4+Mn(HSO4)2+Cl2+2H2O),求原混和物中氯酸钾和高锰酸钾的质量各为多少?
[提示]:
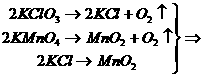 2KClO3+2KMnO4-4O2
2KClO3+2KMnO4-4O2
2KClO3+2KMnO4-4O2
2KClO3+2KMnO4-4O2
245克 316克 22.4×4升
X克 Y克 1792×10-3升 解得:X=4.9克 Y=6.32克
2.a摩P跟b摩氯气完全反应生成PCl3和PCl5的混和物,则混和物中PCl3与PCl5的物质的量之比是多少?
[解]:根据反应式:aP+bCl2 == xPCl3+yPCl5
根据质量守恒定律可列出:
3x+5y = 2b x+y = a
解得:x=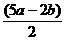 y=
y=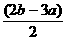
所以:x:y = (5a-2b):(2b-3a)
1.某未知纯净气体A,取其标准状况下体积均为2.24升的两份样品,一份与过量的氧气混和,燃烧后无固体物质生成.气体生成物均被过量的Ca(OH)2溶液吸收,得13.90克沉淀;另一份在标准状况下与一定质量的二氧化硫气体混和,测得混和气体对氢气的相对密度为20,求二氧化硫气体的质量(二氧化硫与A不反应).
[分析]:通常情况下,我们先考虑分子量小于40的碳的化合物,如甲烷、乙烷、乙炔、乙烯等,但由于气体总量为0.1摩尔,它们的燃烧产物如果被过量的石灰水吸收,生成的碳酸钙沉淀只能是10克的整数倍,现题目告知生成的沉淀为13.9克,本来甲烷与其它的二碳烃组合有可能出现这个结果,但又被题给条件所否定:因为2.24升(标况)的气体A是纯净物;而H2S由于它与SO2会发生反应也不符合条件,虽然PH3则的燃烧产物可以与石灰水反应生成Ca3(PO4)2,但由于它的燃烧产物是固体也被淘汰。
[解]:从以上的分析可以推断,气体A为CH3F,现验证如下:
(1)它的分子量为34,小于40
(2)0.10摩尔可生成CO20.10摩尔,同时还有0.10摩尔HF:
2 CH3F+3O2 2CO2+2HF+2H2O
2CO2+2HF+2H2O
生成的CO2和 HF与过量的石灰水反应生成0.10摩尔CaCO3与0.05摩尔CaF2(沉淀).质量总计13.9克。
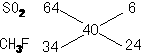
CH3F与SO2两者混和时的体积比为6:24=1:4,已知CH3F的量为0.10摩尔,则SO2的量应是它的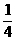 ,却0.025摩尔,所以SO2的质量为64×0.025=1.6克。
,却0.025摩尔,所以SO2的质量为64×0.025=1.6克。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com