
题目列表(包括答案和解析)
14.把29克铁和硫的混和物在密闭条件下加热反应,冷却至室温,再加入足量稀硫酸后,放出的气体在标准状况下为8.4升,则混和物中硫和铁的物质量之比为[答:硫:铁=3:2] [提示:产生的气体体积只与铁的量有关,而与硫的量无关]
13.实验测得化合物A中各元素质量百分组成为钾a%,硫b%,其余是氧;B中含钾d%,硒e%,其余是氧,若A、B的化学式相似,且已知硫原子量为32,则硒的原子量是多少?[答:Se的原子量=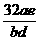 ]
[提示]:由于化学式相似,故有如下的表示式:
]
[提示]:由于化学式相似,故有如下的表示式:
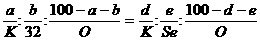 ,可以解得:Se的原子量=
,可以解得:Se的原子量=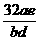
12.人体里的氧元素的质量占休重的65%,而氧原子的原子百分含量为25.5%;已知碳原子的百分含量为9.5%,则碳元素占体重的[答:18.16%]
[提示]:原子个数比=物质的量之比,所以,
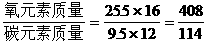 ,也就有下列关系:
,也就有下列关系:
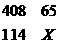 解得X=18.16
解得X=18.16
11.近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,第一步是用Na2SO3吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3, 同时得到含高浓度SO2的水蒸汽副产品,试写出上述两步反应的化学方程式。 [答:Na2SO3+SO2+H2O = 2NaHSO3、2NaHSO3 == Na2SO3+SO2+H2O]
10.工业上产生的硫化氢要经处理成硫后方能排放,以防止大气污染。富玛克斯法治理硫化氢的方法和步聚如下: (1)用2%-3%的Na2CO3溶液做吸收剂生成两种酸式盐 (2)再加入一种RNO(R表示芳香族有机物的基)与生成的一种酸式盐的水溶液反应生成硫、碱和R-NH-OH (3)第(2)步生成的碱在溶液中与另一种酸式盐反应生成正盐 (4)R-NH-OH与空气中的氧发生反应又得到RNO 试写出以上四步反应的化学方程式 [答]:(1)Na2CO3+H2S == NaHCO3+NaHS (2)NaHS+RNO+H2O == S+NaOH+R-NH-OH (3)NaOH+NaHCO3 == Na2CO3+H2O (4)2R-NH-OH+O2 == 2RNO+2H2O
9.某无色溶液可能含有下列钠盐中的几种:(A)氯化钠(B)硫化钠(C)亚硫酸钠(D)硫代硫酸钠(E)硫酸钠(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含[答:SO2](填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是:[答:B、C、F]
第二种情况是:[答:B、D、F]
第三种情况是:
第四种情况是:
8.酸雨主要是燃烧含硫燃料时释放出SO2所造成的。现取一份雨水样品,每隔一定的时间测定其PH值,测定结果见附表
附表 雨水样品PH值随时间的变化值
|
测试时间(h) |
0 |
1 |
2 |
4 |
8 |
|
雨水样品PH值 |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
试说明雨水样品PH值减小的原因 [提示]:由上述数据可见,开始时样品的PH值随时间的推移而减小,一定时间后雨水样品的PH值不再发生变化。对于某一份在实验室里待测的雨水言,二氧化硫的继续溶解和挥发均可忽略不计,那么,其水溶液PH值的降低只能是它被空气中的氧气氧化成硫酸(强酸)所致:2SO2+2H2O+O2 == 2H2SO4。一定时间后,样品中的二氧化硫反应完全,PH值趋稳定。
7.将x摩尔H2S和1摩尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况:(忽略气体的溶解)
(1)全部是SO2,此时的x的取值范围是 ,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是 ,容器内气体的物质的量为 摩(用含x的关系式表示)
[解]:该反应的化学方程式可表示如下:
xH2S+1O2 = 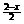 SO2+
SO2+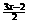 S+xH2O
S+xH2O
(1)当氧化产物全部是SO2,此时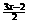 =0,由此可得当氧气不过量时x=
=0,由此可得当氧气不过量时x=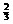 ,考虑到氧气可以 过量,所以x值的合理取值范围应是x£
,考虑到氧气可以 过量,所以x值的合理取值范围应是x£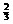 ;同时可以发现,反应后生成的SO2的分子量比H2S大,所以反应后气体密度增大,所以d1<
d2
;同时可以发现,反应后生成的SO2的分子量比H2S大,所以反应后气体密度增大,所以d1<
d2
(2) 当氧化产物全部是S,此时, 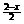 =0,x=2,考虑到要满足H2S过量这一条件,所以x³2
=0,x=2,考虑到要满足H2S过量这一条件,所以x³2
(3)x值介于(1)与(2)这间,也就是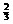 <x<2
<x<2
6.有两种无机盐A和B,其分子量都120,为了确定A和B,将它们分别溶于水制成溶液,进行下列实验:①将两种溶液混和立即产生一种易溶于水、易液化的气体;②在两种溶液中分别加入氯化钡溶液,A溶液无沉淀产生,B溶液里有白色沉淀柝出;③在两种溶液里分别加入过量的氢氧化钡溶液均有白色沉淀产生,请确定A、B两种盐的名称。
[解]:A:亚硫酸氢钾 B:硫酸氢钠
5.(1)已知反应2H2S+O2 == 2H2O+2S 2H2S+3O2 == 2H2O+2SO2 S+O2 == SO2,设n代表物质的量,则当比值:
[提示]:H2S与O2的总反应可表示如下:
xH2S+yO2
== 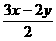 S+
S+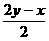 SO2+xH2O,以上各个结果均可由对该式的讨论得到。
SO2+xH2O,以上各个结果均可由对该式的讨论得到。
(2)在相同状况下,50毫升H2S和60毫升O2混和,当完全反应后,在同温同压下生成SO2 :
[答]:35毫升。
[提示]:可采用直接配平法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com