
题目列表(包括答案和解析)
7.某Na2SO3样品已部分被氧化为Na2SO4,经测定该混和物中含硫25%,则混和物中Na2SO3与Na2SO4的物质的量之比为-------------------------------------(D)
A.7:6 B.6:7 C.1:7 D.7:1
[提示]:设 的总量为1mol,部分被氧化后,剩余的
的总量为1mol,部分被氧化后,剩余的 的量为(1-x)mol,生成
的量为(1-x)mol,生成 的量为xmol,则有
的量为xmol,则有 ,解得x=
,解得x=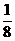 ,则可求得最后两者的物质的量之比为7:1。如果引题用十字交叉法求解也可以,但一定要注意得出的值可能是质量比,要将质量比换算成物质的量之比。
,则可求得最后两者的物质的量之比为7:1。如果引题用十字交叉法求解也可以,但一定要注意得出的值可能是质量比,要将质量比换算成物质的量之比。
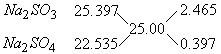 2.465:0.397=6.21:1(质量比)
2.465:0.397=6.21:1(质量比)
 与
与 的物质的量之比=
的物质的量之比= =7:1
=7:1
6.某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化合价数值为---------------------------------------------------------------(C)
A.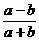 B.
B. C.
C. D.
D.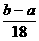 [提示:C是奇数价时的值,当其为偶数价时,此值为
[提示:C是奇数价时的值,当其为偶数价时,此值为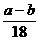 ]
]
5.密度为1.45克/厘米3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止。已知沉淀物与原溶液的质量相等,则原硫酸溶液的物质的量浓度为------(D)
A.29.6% B.42.1% C.14.8摩/升 D.6.22摩/升
4.a克铜与足量的浓硫酸共热,完全反应产生标况下b升气体,则被还原的硫酸不可能是------------------------------------------------------------------------------(BC)
A. B.
B. C.
C.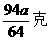 D.
D.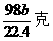
3.将H2S和O2的混和气体,在120℃的温度下,装入密闭容器中,在高温下使之反应。已知全部的H2S和O2都参加了反应,反应后测得压强为反应前的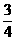 倍,则原混和气体中H2S和O2的物质的量之比为---------------------------------(A)
倍,则原混和气体中H2S和O2的物质的量之比为---------------------------------(A)
A.1:1 B.1:2 C.2:1 D.3:2
[提示]: xH2S+yO2
= S+
S+ SO2+xH2O
SO2+xH2O
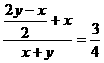
 =1
=1
2.在体积可变的密闭容器中,将等体积的H2 S和SO2 在常温常压下混合,充分反应后,气体体积与反应前气体体积之比为---------------------------------( C )
A. B.
B.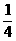 C.小于
C.小于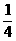 D.大于
D.大于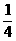
[提示]:过量的SO2 溶于生成的水中
1.在氯化钡溶液中通入SO2 ,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2 ,结果两试管中都有白色沉淀生成.由此得出下列结论合理的是-----------------------------------------------(C D)
A.氯化钡有两性
B.两支试管中的白色沉淀都是BaSO4
C.SO2 具有还原性和酸性
D.升高PH值使SO2 水溶液中SO3 2- 浓度增大
9.
8.接触法制硫酸是先把SO2催化氧化成SO3,然后用水和浓硫酸吸收。某工厂接触室“出口气体”中含有N2、O2和少量SO2及体积分数为10%的SO3。把“出口气体”送进吸收塔,使SO3转化成发烟硫酸(可以看作是H2SO4与SO3的混和物),其中SO3的质量分数为20%。请计算: (1)若发烟硫酸用H2SO4·xSO3表示,则x的值是多少? (2)若只用水吸收SO3(假设吸收完全)生产该发烟硫酸,求出448立方米(已折算成标准状况)“出口气体”所需用水的质量。 (3)若只用98%的浓硫酸来完全吸收SO3生产发烟硫酸,计算出448立方米(已折算成标准状况)“出口气体”所需用98%H2SO4的质量。 [答]:(1)0.306 (2)2.76×104克 (3)4.43×105
7.
某碳酸钙、亚硫酸钙的混和物,经分析知含钙的质量分数为36%,求其中的含碳、硫、氧的质量分数各是多少?
[解](1)由碳酸钙、亚硫酸钙的化学式可知:
O%=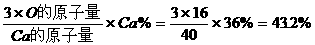 (2)设碳酸钙与亚硫酸钙的物质的量之比为1:X,则依题意得:
Ca%=
(2)设碳酸钙与亚硫酸钙的物质的量之比为1:X,则依题意得:
Ca%= ,解得X=1.25
S%=
,解得X=1.25
S%= C%=
C%=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com