
题目列表(包括答案和解析)
4.在标准状况下,将100毫升H2S和O2混合气体点燃反应后恢复到原状况,发现随 混和气体中O2所占的体积V氧气的变化,反应后所得气体的总体积V总也不同,其关系式如下图所示(气体体积均在同温同压下测定)。请回答下列问题:
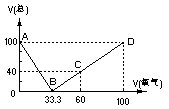
(1)写出图中B、C两点处的化学反应方程式
[答]:B点的反应:2H2S+O2 == 2S+2H2O C点的反应:2H2S+3O2 == 2SO2+2H2O
(2)通过对图像的分析得出:
①当V总>40毫升、②V总<40毫升、③V总=40毫升时气体的成分 [答]:
|
|
AB段 |
BD段 |
|
①V总>40毫升 |
H2S |
O2与SO2 |
|
②V总<40毫升 |
H2S或没有 |
SO2或没有 |
|
③V总=40毫升 |
H2S |
SO2 |
(3) 当V总=25毫升时,求原混合气体中H2S和O2的体积各多少毫升?
[答]:当V总=25毫升时,从图中可以看出,在AB段与BD段均有可能。
(1)当在AB段时,H2S过量,反应后剩余的气体就是过量的H2S。设原混和物中O2的体积为x毫升、H2S的体积为2x+y毫升(y毫升就是过量的H2S的体积),由题给条件可列出以下两式:
x+2x+y=100----------① 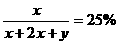 (或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75毫升,O2的体积为25毫升。
(2)当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
==
(或直接写出x=25)-----②
解得:x=y=25,所以原混和气体中H2S的体积为75毫升,O2的体积为25毫升。
(2)当在BD段时,两者的反应可直接写成以下的形式:
xH2S+yO2
== S+
S+ SO2+xH2O
SO2+xH2O
其中x+y=100,所以 =0.25,解得:x=y=50毫升
所以原混和气体中两种气体的体积均为50毫升。
=0.25,解得:x=y=50毫升
所以原混和气体中两种气体的体积均为50毫升。
3.常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如下图的转变关系,试回答:

(1)A是[答:S]B是[答:H2S]C是[答:SO2]
(2)B的物质的量为x,氧气的物质的量为y,则当B跟氧气恰好反应,完全转化为A时, x与y 的数值关系为[答:y=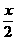 ];若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是[答:
];若当B转化为C时,反应后,常温下体系中只有C一种气体,x与y的数值关系是[答: 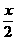 <y£
<y£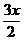 ]
]
[提示]:可采用直接配平法
0.05 摩 x x=1.12 升
2.取50毫升Na2CO3 和Na2SO4 的混和溶液,加入过量氯化钡溶液后得到 14.51克白色沉淀,用过稀硝酸处理后沉淀减少到4.66克,并有气体放出.试计算:
⑴原混和溶液中Na2CO3 和Na2SO4 的物质的量的浓度
⑵产生的气体在标准状况下的体积
[解]:⑴14.51克白色沉淀是BaCO3 和BaSO4 的混和物
Na2SO4
的物质的量=BaSO4
的物质的量= =0.02 摩
=0.02 摩
所以Na2SO4 的物质的量的浓度=0.02/0.05=0.40 摩/升
Na2CO3 的质量=14.51-4.66=9.85克
Na2CO3
的物质的量=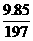 =0.05 摩
=0.05 摩
Na2CO3的物质的量的浓度为=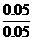 =1 摩/升
=1 摩/升
⑵设生成的气体在标准状况下的体积为x升
BaCO3+2HNO3 =Ba(NO3)2+H2O+CO2 ↑
1 摩 22.4 升
1.m克铁粉和n克硫粉混和共热后(不考虑Fe与O2)的反应,将反应混和物溶于足量的稀盐酸中,则标况下可产生气体[答: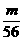 ×22.4升]
×22.4升]
15.
计 算 题
14.有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z,X、Y、Z之间也能相互发生反应。已知X是由a和b元素按原子个数比1:1组成的化合物,其他元素形成的单质(仍用a、b、c表示)和组成的化合物之间的反应关系如下(未配平)
Ⅰ、b + c→Y Ⅱ、a+c→Z Ⅲ、X+Y→m Ⅳ、X+Z→c+n Ⅴ、Y+Z→c+n
(1)上述反应中,最有充分理由说明该反应一定属于氧化还原反应的
是 ▲ (填反应编号)。 [答:Ⅰ、Ⅱ、Ⅳ、Ⅴ]
(2) 如果m是一种无色粘稠油状液体化合物,则X、Y、Z的化学式分别是 ▲ 、 ▲ 、 ▲ 。
[答: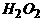
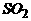
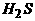 ]
]
(3)Ⅲ步反应的化学方程式是 ▲ 。
[答: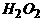 +
+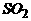 =
=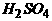 ]
]
(4)Ⅳ步反应的化学方程式是
▲ 。
[答: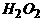 +
+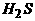 =S¯+2
=S¯+2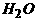 ]
]
13.在FeSO4、Fe2(SO4)3、BaSO4、Al2(SO4)3的混和物中,氧元素含量的质量百分比为a%,试求含硫元素的质量百分比及Fe,Ba,Al三元素质量的总和占混和物质量的百分比.[答: 0.5a%、1-1.5a%]
12.某亚硫酸钠已部分被氧化成硫酸钠,经测定该混和物含硫25%,则混和物中亚硫酸钠与硫酸钠的物质的量之比为[答:7:1]
11.某氧化剂中,起氧化作用的是X2O72-,在溶液中0.2 mol的该离子恰好能使0.6mol的SO32-完全氧化,则X2O72-被还原后元素X的化合价为[答:+3] 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com