
题目列表(包括答案和解析)
7.氢氧化钴[Co(OH)2]能与酸性溶液反应,可作涂料和清漆的干燥剂。制备方法为:
①Co + 2HCl == CoCl2 + H2↑;②CoCl2+2NaOH == Co(OH)2↓+ 2NaCl
下列判断错误的是
A.①为置换反应 B.氢氧化钴可以干燥氯化氢气体
C.②为复分解反应 D.钴的金属活动性比铜的强
6.下列处理事故的方法错误的是
A.厨房煤气管道漏气,立即关闭阀门并开窗通风
B.电器着火应先切断电源,再用二氧化碳灭火器扑灭
C.图书馆内图书起火,立即用泡沫灭火器扑灭
D.扑灭森林火灾的有效方法之一,是将大火蔓延路线前的一片树木砍掉
5.下列实验操作错误的是
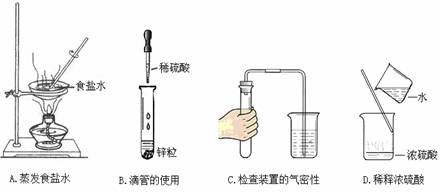
4.下列说法错误的是
A.红磷在氧气中燃烧时,产生大量白烟
B.木炭在氧气中燃烧时,发出白光,生成黑色固体
C.铁丝在氧气中剧烈燃烧时,火星四射,生成黑色固体
D.硫粉在氧气中燃烧时,发出蓝紫色火焰,闻到刺激性气味
3.如图所示,在烧杯甲中装入蒸馏水,滴入2滴酚酞试剂,得到无色溶液。在烧杯乙中装入浓氨水。用一只大烧杯把甲、乙罩在一起。几分钟后,发现甲中的溶液变成红色。对上述现象的解释正确的是
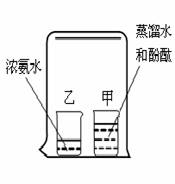 (1)甲内滴入的酚酞要过一会儿才能变色,与乙无关;
(1)甲内滴入的酚酞要过一会儿才能变色,与乙无关;
(2)大烧杯壁上沾有某种物质,散发出的肉眼看不见的微粒与甲中 的溶液接触,使其变红;
(3)乙中的浓氨水中有肉眼见不到的微粒逸出,有些微粒进入了甲中的溶液,使溶液成分改变,并使溶液变红。
(4)氨水能使酚酞溶液变红
A.(1)(4) B.(2)(3)
C.(1)(2) D.(3)(4)
2.2011年“5.20”中国学生营养日的主题是:“全面、均衡、适量--培养健康的饮食行为”。 下列各组食物中所含主营养素的类别判断错误的是
|
选项 |
食物 |
所含主营养素 |
|
A |
水果、蔬菜 |
无机盐 |
|
B |
米饭、馒头 |
糖类 |
|
C |
花生米、豆油 |
油脂 |
|
D |
纯牛奶、鸡蛋 |
蛋白质 |
1.从化学的视角来看,下列名句中只发生物理变化的是
A.千锤万凿出深山,烈火焚烧若等闲 B.爆竹声中一岁除,春风送暖入屠苏
C.冰,水为之,而寒于水 D.曾青(指CuSO4溶液)得铁则化为铜
21、学习了氨碱法制取纯碱的知识后,化学兴趣小组的同学对纯碱的性质进行了初步探究,分别做了纯碱与盐酸、氯化钡等物质反应的实验。实验结束后,同学们把“废液”集中收集,并对“废液”的酸碱性进行了测试,结果呈酸性。大家围绕着如何处理“废液”展开了讨论:

取该“废液”样品20mL,用10%的氢氧化钠溶液进行测定,当加入氢氧化钠溶液的质量为8g时,“废液”中的盐酸恰好完全中和,测得溶液的pH刚好等于7.计算20mL“废液”样品中所含HCl的质量是多少?
20、(6分)化学实验是学习化学和进行科学研究的重要方法和途径。学会气体物质的制备方法是研究气体、利用气体的基础。请根据下图回答有关问题:
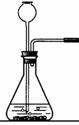 |
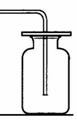 |
 |
 |
  |
 |
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑴在常温下实验室欲制取氧气所选用的装置是 (填序号),为了便于调控反应的进行,可以对发生装置进行改进,请简要说明你的改进措施 。
⑵从上述仪器中选择一种你比较熟悉的仪器,写出它的名称 ,简要写出它的用途 。
⑶同学们以“化学反应中,反应物与生成物的质量关系”为课题进行探究。经讨论分析、查阅资料后设计了A、B两套实验装置,并在实验过程中做到操作规范、准确称量和细致观察。实验完毕后,使用A装置进行实验得到的结果是:反应前后反应物的总质量与生成物的总质量相等;而使用B装置进行实验得到的结果是:反应前后反应物的总质量与生成物的总质量不相等。请你分析导致出现两种不同结果的原因是 。
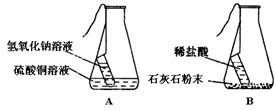
写出B装置中发生反应的化学方程式 。
19、(6分)金属材料被广泛的应用于我们的生活中,不仅是因为其物理性能优良,还与它们的化学性质密切相关。下面是小明同学设计测定金属铁、铜和镁的活动性的探究实验过程和实验记录,请你一起探究。
[实验目的] 测定金属铁、铜和镁的活动性强弱
[所用试剂] 稀硫酸、硝酸银溶液、光亮的薄铁片、薄铜片、薄镁片
[实验过程]
步骤Ⅰ 将铁片、铜片、镁片分别在空气中点燃片刻,观察燃烧现象;
步骤Ⅱ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的稀硫酸的试管中;
 步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
步骤Ⅲ 将铁片、铜片、镁片分别放入三只盛有溶质质量分数相同、体积相同的硝酸银溶液的试管中。
[实验记录]用“√”表示能观察到实验现象,用“-”表示观察不到实验现象(见右表)。
⑴通过步骤Ⅰ可以得出三种金属中镁的金属活动性最强,判断依据是
⑵运用“控制变量法”设计实验方案是化学研究的重要方法。步骤Ⅱ和步骤Ⅲ中,需要控制的实验条件除了金属的体积、溶液的体积、溶质质量分数以外,还需要控制的条件是 。写出镁和稀硫酸反应的化学方程式 ,此反应属于 。
[实验结论]金属铁、铜和镁的活动性由强到弱的顺序是 (用元素符号表示)
[反思交流] 若利用上述试剂制取氢气,小明认为应该选择金属铁和稀硫酸反应,而不选择金属镁和稀硫酸反应,他的理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com