
题目列表(包括答案和解析)
2.下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是--------------------------------------------------------------------------(B)
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
1.如限定使用以下的物质:
盐:钾盐、钠盐、铵盐、钡盐 酸:盐酸、硝酸、醋酸、稀硫酸
那么,符合:2H++SO32- == SO2+H2O这个离子方程式的化学反应式共有----(D)
A.6个 B.9个 C.12个 D.15个
[提示]:不要遗漏硫酸氢盐;能发生该离子反应的物质有以下几种:Na2SO3 K2SO3 (NH4)2SO3 HCl H2SO4 NaHSO4 KHSO4 NH4HSO4
4.NaCl,NaBr,NaI三种溶液可用一种试剂将它们鉴别出来,这种试剂是[答:氯气或硝酸银] 。往含有1.6g溴化钾的溶液中加入含有杂质氯的粗溴6.0g,将混和物蒸发,烘干得残留物1.3g,则粗溴中氯的质量分数是[答:4%]。
[提示]:2KBr+Cl2
== 2KCl+Br2
DW
238
71 149
89
?=0.24
0.3
%=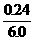 =4%
=4%
3.某含杂质氯化钾的氯酸钾样品,经分析得知其中含有氯元素的质量分数为35.5%,求氯酸钾的纯度。[答:65.1%] [提示]:因为样品中KClO3中只含有杂质KCl,其中均含有“KCl”的成分,故我们可以先假设样品是由“KCl”和“O”组成的,求出“KCl”的质量分数为74.5%,则“O”的质量分数为1-74.5%=25.5%。 样品中KClO3的质量分数可由下式求得: KClO3 - 3O 122.5 48 ?=65.1% 25.5%
4.66 15.46 可解得 n=3
2.将氯元素与溴元素组成的卤素互化物BrCln4.66克溶于水,再通入过量的二氧化硫,使其发生如下反应:
BrCln
+ (n+1) H2O+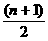 SO2 = HBr+nHCl+
SO2 = HBr+nHCl+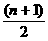 H2SO4
H2SO4
然后向生成的溶液中加入过量的硝酸钡溶液,除去生成的沉淀后,将所得滤液用过量的硝酸银溶液处理,可生成沉淀15.46克,试确定n的值。
[提示]: BrCln - AgBr+nAgCl
80+35.5n 188+143.5n
1.甲、乙两学生用加热氯酸钾的方法制取氧气。甲取一定量氯酸钾和0.10克二氧化锰,经混和后装入试管内加热,待收集到所需氧气时停止。试管冷却后,乙称得甲留下的反应混和物的质量为4.04克,将它继续加热直至其中的氯酸钾完全分解,收集到氧气0.96克,求甲实验时氯酸钾的分解。
[提示]:先从乙实验中放出的0.96克氧气求出甲留下的氯酸钾为2.45克,则甲留下的4.04克固体应是二氧化锰(0.10克)、未分解的氯酸钾(2.45克)、由甲实验时生成的氯化钾(4.04-0.10-2.45克);再从甲实验中生成的氯化钾的质量(1.49克)可求出甲在实验中有2.45克氯酸钾分解,则原混和物中氯酸钾的总质量为4.90克,所以甲实验中氯酸钾的分解率为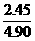 =50%
=50%
43.
计 算 题
42.在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
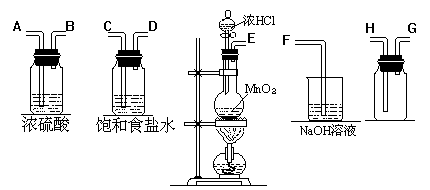
(1)连接上述仪器的正确顺序是(填各接口处的字母):
__▲__接_▲__,__▲_接_▲__,_▲__接__▲__,_▲_接__▲__。
(2)在装置中①饱和食盐水起的作用是_▲_,②浓硫酸起的作用是_▲_。
(3)写出下列化学反应的离子方程式:气体发生装置中进行的反应_▲_。
41.有一KCl和KBr的样品共3.87克,溶于水配成溶液,向溶液中加入过量AgNO3溶液,充分反应后,产生沉淀质量为6.63克,则原样品中钾元素的质量百分含量为[答: 40.3%]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com