
题目列表(包括答案和解析)
17. 14克铜、银合金与足量的某浓度的硝酸反应,将放出气体与1.12升(标况)氧气混合,通入水中恰好全部吸收,则合金中铜的质量是----------------[C] A、9.6克 B、6.4克 C、3.2克 D、1.6克 [提示]:硝酸浓度不必考虑,因为硝酸得到的电子数将在氮的氧化物与氧气反应中全部由氧气补偿。
16.下列原子或离子中,氧化性最强的是------------------------------------[B] 还原性最强的是------------------------------------------------------------------------[A] A.Mg B.Cu2+ C.Fe D.Na+
15.为实现我国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在。已知溶液中IO3-可以与I-发生如下的反应: IO3-+5 I-+6H+ == 3I2+3H2O 据此反应,可用试剂和一些生活中常见的物质进行试验,证明在食盐在存在着IO3-。可供选用的物质是:①自来水 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒。进行上叙实验时必须使用的物质是---------( B ) A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
14.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是------( C ) A.NO2 B.NO C.N2O D.N2
[提示]:根据电子得失守恒可知:
2R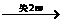 2R(NO3)n(R表示金属元素)
HNO3
2R(NO3)n(R表示金属元素)
HNO3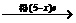
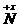 (n表示R的化合价)
即2ne=(5-x)e(x表示还原产物N化合价)
当n=1时,x =3,无答案(N2O3) 当n=2,=+1,答案为C
(n表示R的化合价)
即2ne=(5-x)e(x表示还原产物N化合价)
当n=1时,x =3,无答案(N2O3) 当n=2,=+1,答案为C
13.R2O8n-离子在一定条件下可以把Mn2+氧化成MnO4-,项反应后R2O8n-离子变为RO42-离子,又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是---------------------------------------------------------------------------------------------(B) A.1 B.2 C.3 D.4
12.下列操作不会引起化学反应的是------------------------------------------------(B) A.硝酸亚铁溶液中加入稀硫酸 B.将氧气和氢气以1:2体积比混和 C.向漂白粉中滴加稀硫酸 D.将次氯酸钠溶液与硫化钠溶液混和
99.第二周期非金属元素形成常温下的气态氢化物和气态氧化物的种类--(A)
A.前者大 B.后者大 C.相等 D.不能确定
11.元素周期律与原子结构理论出现的年号-------------------------------------(B) A.前者大 B.后者大 C.相等 D.不能确定
10.不同的卤素原子之间能形成卤素互化物,其通式可表示为XX¢n(n=1、3、5、7)。这种卤化物大多数不稳定,易发生水解反应。如果BrFn跟水反应时物质的量之比为3:5,生成溴酸、氢氟酸、溴单质和氧气,则下列叙述正确的是------------------------------------(AC)
A.此卤素互化物的分子式为BrF3
B. 此卤素互化物的分子式为BrF5
C.每摩BrFn跟水完全反应可生成等物质量的Br2和O2
D. BrFn的许多性质类似于卤素单质,有强的还原性
[提示]:先写出如下的反应式:
3BrFn+5H2O
= (10-3n)HBrO3+3nHF+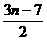 Br2+
Br2+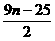 O2
O2
由于10-3n>0 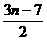 >0
>0 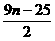 >0,可得唯一解:n=3
>0,可得唯一解:n=3
9.KClO3和MnO2混和物20.95克,加热到质量不再减少时为止,剩余固体16.15克,向剩余物中加入过量浓硫酸可放出气体,该气体与过量KI反应,生成的I2用Na2S2O3溶液吸收:
I2+2Na2S2O3==2NaI+Na2S4O6,问需1摩/升的Na2S2O3溶液几毫升,才能把生成的I2全部吸收------------------------------------------------------------------------------(C)
A.50毫升 B.33.3毫升 C.100毫升 D.66.7毫升
[提示]:加热反应后生成的MnCl2在过量的浓硫酸作用下,其中的氯元素全部被氧化成氯气MnCl2 Cl2,如果不注意到这一点,很可能受到教材中的反应:MnO2+4HCl
== MnCl2+Cl2+2H2O的影响而错选A
Cl2,如果不注意到这一点,很可能受到教材中的反应:MnO2+4HCl
== MnCl2+Cl2+2H2O的影响而错选A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com