
题目列表(包括答案和解析)
20、(本题共12分)
(1)_______ ___; _____ _____。
(2)__ __。
(3)你的猜想是:__ __。
设计实验___ ___
。
(4)___ _。(写化学式)
19、(本题共10分)请按要求填空:
(1)________(填序号)
(2)(ⅰ)__________ ____________
。
(ⅱ)__________________(填名称)。
(ⅲ)应注意________ ___;
(计算结果保留1位小数)
26、(12分)有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀。试回答下列问题:
⑴产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
|
组别 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
甲 |
B |
|
|
|
|
|
|
|
|
乙 |
D |
|
|
|
|
|
|
|
 ⑵请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
⑵请在下列坐标中作出第1组实验所得沉淀的物质的量(n沉淀/mol)随B溶液体积(VB/L)变化的曲线。
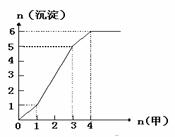 ⑶右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式)、乙 (填化学式)。
⑶右图是某一组实验中所得沉淀的物质的量(n沉淀/mol)随甲溶液中溶质的物质的量(n甲/mol)变化的曲线。符合下图曲线的试剂组合是:甲 (填化学式)、乙 (填化学式)。
① 若实验时取用的乙溶液为500 mL,试计算乙溶液中溶质的物质的量的浓度。
②若向500 mL乙溶液中滴加1 000 mL甲溶液时恰好得到bmol(1<b<5)白色沉淀,请计算甲溶液中溶质的物质的量浓度。
第Ⅱ卷(非选择题 共76分)答题卷 姓名 得分
25、(8分)将固体FeC2O4·2H2O放在一个可以称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
|
温度℃ |
25 |
300 |
350 |
400 |
500 |
600 |
900 |
|
固体质量 |
1.000 |
0.800 |
0.800 |
0.400 |
0.444 |
0.444 |
0.430 |
根据计算分析推理,完成下列填空:
(1)写出25~300℃时固体发生变化的反应方程式______________________
判断的理由是___________________________________________________
(2)350~400℃发生变化得到的产物是____________________________
物质的量之比是_________________________
(3)500℃时产物的含氧质量分数为____________________________
(4)写出600~900℃时发生变化的化学方程式_______________________
24.(12分)下面是有名的Diels-Alder反应的一个实例:
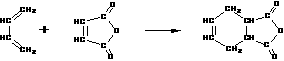
也可用下面相应的键线式表示:
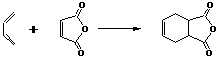
请认真分析上述变化,回答下列问题:
(1)写出下列反应产物的结构简式:
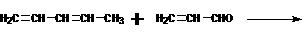
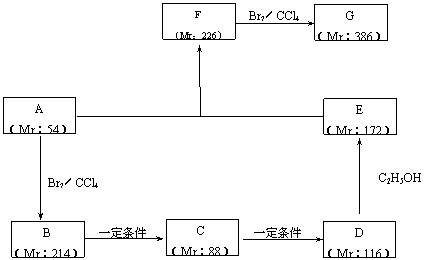 (2)以某链烃A为起始原料合成化合物X的路径如下(图中Mr表示相对分子质量):
(2)以某链烃A为起始原料合成化合物X的路径如下(图中Mr表示相对分子质量):
①指出反应类型:B→C : ,F→G : 。
②写出下列物质的结构简式:
A : ,F : 。
③写出下列反应的化学方程式:
B → C : ;
D → E : 。
23.(8分) 某共价化合物含C、H、N三元素,分子内有4个N原子,且4个N原子排列成内空的四面体(如白磷分子结构),每两个N原子间都有一个C原子,分子内无C-C单键和C=C双键。
(1)试确定该化合物的分子式:

(2)假若某大分子,分子内只含C、H、P三种元素,其最小的重复的结构单元可以表示为:
当该化合物分子中含n 个磷原子时,则该化合物的组成可表示为:______。
22.(10分)A通常存在于钢铁中,它是由甲、乙两种化合物组成的混合物,甲和乙的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜进行机械加工。
已知:(1)甲和乙的组成元素相同,均是由两种常见元素的原子以最简整数比构成的化合物,其相对分子质量分别为124、180。(2)C、D、H、I、J常温下为气体,H、I、J为单质,D是一种红棕色气体。(3)反应②为制备理想的绿色水处理剂Na2FeO4(高铁酸钠)的一种方法。(图中部分生成物没有列出。)
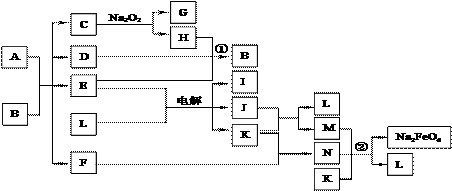 请填写以下空白:
请填写以下空白:
⑴写出C的电子式 。
⑵写出反应①的化学方程式 。反应②的离子方程式 。
⑶甲和乙的化学式分别为 、 ,若A中组成元素的物质的量之比为4∶9,则乙在A中的物质的量分数为 。
21.(8分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,D、E同主族,A、B的最外层电子数之和与C的最外层电子数相等,A、C、D的质子数之和与E的原子序数相等, A能分别与B、C 、D形成电子总数相等的分子。D、E均能形成多种同素异形体。
请回答:
⑴D和E的氢化物中,沸点较低的是 (写氢化物分子式)。
⑵下图为C元素的某种单质的晶体片段结构图,该晶体中每个C原子都通过三个单键与其它C原子结合并向空间发展构成立体网状结构。则该晶体属于 晶体(填原子、分子、离子等),该晶体中原子个数与共价键数之比为 。
⑶甲、乙两种盐中都含有A、B、C、D四种元素,甲盐中A、B、C、D四种元素的原子个数比为4∶1∶1∶2,将一定量的晶体物质甲,放在真空的密闭容器中加热到200℃时,甲全部分解为4种气体,其中四种气体的物质的量之比为2﹕1﹕1﹕1。若再冷却容器到一定温度时,又发现有晶体物质乙生成,此时容器中只剩一种气体,该气体未参加反应,已知该气体在相同条件下相对于氢气的相对密度为14,而且能够在空气中燃烧。则甲的化学式为 ,乙的化学式 。甲分解的化学方程式为 。
20、(本题共12分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
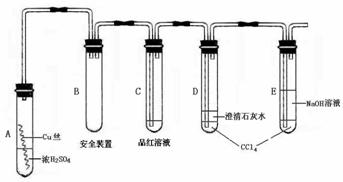
实验选用细铜丝、98.3% H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。

|
根据上述材料回答下列问题
(1)A试管上方的长导管的作用是__________;D、E两支试管中CCl4的作用是__________。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式:____。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是:____。设计实验验证你的猜想______。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是____。(写化学式)
19、(本题共10分)请按要求填空:
(1)下列实验操作或对实验事实的叙述中存在错误的是________(填序号)
A、用50 mL酸式滴定管准确量取25.00 mL 酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备
E、配制1 mol•L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
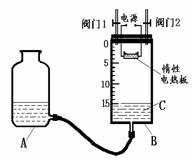 (2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。
(2)某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。
操作步骤:
①检查装置的气密性。
②将0.5 g 红磷平铺在电热板上,盖紧容器。
③打开阀门1、阀门2,从A的瓶口加入液体C,使B中液面至刻度15.0 cm。
④向B中充入氯气,待氯气充满后关闭阀门1、阀门2,通电加热红磷。……
请回答下列问题:
(ⅰ)检查装置气密性具体方法是______________________。
(ⅱ)实验步骤③加入的液体C是__________________(填名称)。
(ⅲ)反应结束并充分冷却后,读取B中液面刻度读数时,应注意________;若液面在刻度5.6 cm处,此时实验条件近似看作标准状况, 则生成物PClx中x的值是 (计算结果保留1位小数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com