
题目列表(包括答案和解析)
22.(6分)NaHSO4是一种酸式盐,
(1)NaHSO4晶体熔化时的电离方程式
(2)0.1mol/l NaHSO4溶液的PH=
(3)NaHSO4溶液与NaHSO3溶液反应的离子方程式
21、(8分)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶
液与pH =12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”),理由是 。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的氧化剂是 ,反应的离子方程式可表示为:
20.判断下列有关硒的叙述不正确的是 ( )
①硒化氢比硫化氢稳定②硒在空气中燃烧生成SeO2, 和钠反应生成Na2Se
③硒化氢在空气中不能燃烧 ④ SeO2既有氧化性又有还原性
⑤SeO2可被NaOH溶液吸收 ⑥Cu+Se=CuSe ⑦H2Se通入SO2溶液中,无明显现象
A.只有① B。只有①⑤⑥ C。只有①③⑥ D。只有①③⑥⑦
19、某无色气体可能由O2、CO2、HCl、NH3、NO、Br2中的一 种或几种组成,通过图中洗气瓶后气体体积减小,通过干燥管后气体呈红棕色,则下列推断正确的是
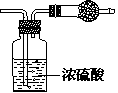 A.干燥管内固体为碱石灰
A.干燥管内固体为碱石灰
B.原气体中一定有NO和O2
C.原气体中一定有NH3、NO、CO2
D.原气体中一定没有HCl、Br2、CO2
18、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢 氧化钠溶液,生成沉淀的质量为( )
A、9.02g B、8.51g C、8.26g D、7.04g
17.为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是 ( )
A.K2SO3是否被氧化(BaCl2) B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.漂粉精是否变质(盐酸)
16.下列离子方程式书写正确的是 ( )
A.用湿润的醋酸铅试纸检验硫化氢:H2S + Pb2+ = PbS↓ + 2H+
B.将标准状况下112mL氯气通入10mL浓度为1mol·L-1的溴化亚铁溶液中:
2Fe 2++4Br-+3Cl2=3Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
15.已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是 ( )
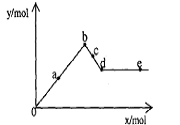 A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
A.a-b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c-d时溶液中离子的物质的量:AlO2-比Ba2+少
C.a-d时沉淀的物质的量:BaSO4可能小于A1(OH)3
D.d-e时溶液中离子的物质的量:Ba2+可能等于OH-
14.下列说法正确的是 ( )
A.200 mL,1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42-离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.30 g甲醛中含共用电子对总数为4×6.02×1023
D.0.1 mol 8135Br原子中含中子数为3.5×6.02×1023
13、为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加Ag NO3溶液,产生白色沉淀。根据实验以下推测正确的是 ( )
A 一定有SO32-离子 B 不一定有CO32-离子
C 不能确定Cl-离子是否存在 D 不能确定HCO3-离子是否存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com