
题目列表(包括答案和解析)
1、分别用下列仪器量取一定量的溶液俯视读数,液体体积一定偏高的是
(A)滴定管 (B)刻度移液管 (C)量筒 (D)容量瓶
06.10.19
一 选择题(每小题只有一个选项符合题意)
27.(6分)化合物KxFe(C2O4)y·z H2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.491g两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3mol∙L-1H2SO4和适量的蒸馏水,加热到75℃,趁热加入0.0500mol∙L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3+完全转化为Fe2+,该溶液中Fe2+刚好与4.0mL 0.0500mol∙L-1KMnO4溶液完全反应。
通过计算,分别求:
(1)0.491g样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
已知:2KMnO4 + 5H2C2O4 + 3H2SO4 == 2MnSO4 + K2SO4 + 10CO2↑+ 8H2O
MnO4-+ 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
26.(8分)某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
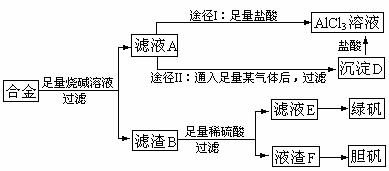
试回答下列问题:
(1)写出合金溶于足量烧碱溶液时相关反应的离子方程式_______________________;写出途径I中相关反应的离子方程式____________________________________。
(2)由滤液A制AlCl3溶液有途径Ⅰ和途径Ⅱ两种,你认为哪种途径比较合理,说明理由_________________________________________。
(3)从滤液E中得到绿矾的实验操作是___________________________________。
(4)按环保要求,写出用滤渣F制备胆矾的各步反应的化学方程式__________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改为盐酸,重新设计方案,也能得到三种物质,你认为后者的方案是否更合理,理由是__________________________________。
25.(5分)甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种化合物,转化关系如图所示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为气态;丁是日常生活中的一种常见金属。
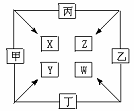 ②常温下,X是无色液体,Y是黑色固体。
②常温下,X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。
请填空:
(1)丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应方程式:
负极:____________________________
正极:____________________________。
(2)将少量W的饱和溶液滴入热的X中可制得胶体溶液,反应的化学方程式为:
__ _______________。
(3)将Y看成碱性氧化物,Y与Z的溶液发生反应的离子方程式是:
_ ____ _。
(4)若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比为_________________。
24.(8分)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ;若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 等杂质(用化学式表示)。
(3)过滤所得的母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3等,需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol∙L-1 )的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL;再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
23.(4分)已知:①短周期元素A、B、C、D的原子序数依次增大。②A、B、D的单质都能在C的单质中燃烧,分别生成化合物X、Y、Z。③X分别与Y、Z反应生成化合物E、F。④单质D也能在化合物Y中燃烧生成B的单质和化合物Z。⑤单质D还能与热的化合物X反应生成A的单质和化合物F。请回答下列问题:
(1)写出A的元素符号。 (2)写出D的原子结构示意图。
(3)写出④中反应的化学方程式。 (4)写出⑤中反应的化学方程式。
22.(5分)填写下列空白:
(1)下图是高中化学课本中的实验装置图,装置B中有关反应的化学方程式为___________________________________________。

(2)元素周期表中位置相近就会有某些相似的性质,如硅、铝两元素也有一些相似的化学性质,请举一例说明硅、铝性质的相似性(用化学方程式表示):______________________。
(3)过氧化钠投入氯化亚铁溶液中,会立即观察到红褐色沉淀,同时有无色气泡。写出跟生成红褐色沉淀相关的化学方程式:________________________________。
(4)写出一例生成氢氧化铁并且属于化合反应的化学方程式____________________。
21.(4分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(1)阴影部分元素Bi属于_______(填“金属”或“非金属”)元素,这种元素的的主要化合价有_________。
(2) 在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) ___ 。
在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) ___ 。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子中浓度最大是 _______ 。
20.在含有FeCl3和BaCl2的酸性混合液中,通入足量SO2气体,有白色沉淀生成,过滤后,向滤液中滴加KSCN溶液,不出现红色,由此得出的结论是( )
A.白色沉淀是BaSO3 B.白色沉淀是BaSO4
C.白色沉淀是BaSO3 和S D.白色沉淀是Fe SO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com