
题目列表(包括答案和解析)
2. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
A.一个D2O分子所含2的中子数为8
B.NH3的结构式为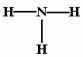
C.HCl的电子式为 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
1. 空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
28.(10分)六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH) 3沉淀.其主要反应的化学方程式如下:
H2Cr2O7+ 6FeSO4+ 6H2SO4 ═ 3Fe2(SO4)3 + Cr2(SO4)3 + 7H2O
(1)现取某地区含铬废水250 mL,分别取出3份,每份25.00mL用0.005625 mol∙L-1 FeSO4溶液滴定,分别用去19.98 mL,20.02 mL 和22.08 mL FeSO4溶液。则该地区每升含铬废水中含铬的质量为多少m g
用上法处理1×104升含铬(+6价)的废水,试回答:
(2)处理后,沉淀物中除Cr(OH)3 外, 还有 、 (用化学式表示).
(3)需用绿矾多少千克?
27.(5分)
在恒温时,向某密闭容器中通入2 mol X和 1 mol Y气体,发生如下反应:
2X(g)+Y(g) 2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时 Z的体积分数为0.4。
(l)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和 2 mol Y(g),
达到平衡,则Z的体积分数为_____________;
平衡时,气体X的体积分数为是_____________。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和 Y(g)的物质的量分别记为 n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则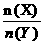 的取值范围为______________。
的取值范围为______________。
26. (12分)已知有机物分子中的烯键可发生臭氧化分解反应,例如:
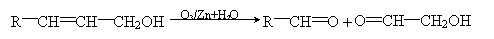
有机物A的分子式是C20H26O6,它可以在一定条件下发生缩聚反应合成一种感光性高分子B,B在微电子工业上作光刻胶。

有机物A的部分性质如下图所示:

试根据上述信息结合所学知识,回答:
(1) 化合物A、C、E中,具有酯的结构的是
(2) 写出下列化合物的结构简式:
C: ,D: ,E: ,B:
(3) 写出反应类型:
反应Ⅱ ,反应Ⅲ 。
(4) 写出反应Ⅱ的化学方程式(有机物要写结构简式):
25.(8分) (1)相对分子质量为84的烯烃,主链上有4个碳原子,可能有 种结构式,分别写出它们结构简式中的任意两种 符合上述条件的烯烃中与H2加成后的产物其一氯代物只有2种,写出其中任意一种一氯代物的名称 和对应的结构简式
(2)已知某碳氢化合物A的分子式中:①有六个碳原子;②每个碳原子都以3个键长相等的单键分别跟其它3个碳原子相连,形成2个90∘的碳─碳─碳键角和一个60∘的碳─碳─碳键角。
根据以上事实判断A的分子中 (填“有”或“没有”)碳碳双键,A的结构可以表示为 (只要求写出碳架,不要求写出C、H符号)。
24.(8分)
(1)室温下,将2 g 苯(C6H6)完全燃烧生成液态水和CO2,放出83.6 kJ的热量,
写出C6H6燃烧的热化学方程式
。
(2)若l g水蒸汽转化成液态水放热2.44 kJ,则室温下C6H6完全燃烧生成1 mol水蒸气时的反应热为 。
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气,
构成燃料电池,则通入甲烷气体的极是原电池的 ,
该极的电极反应是 ,
电池工作时的总反应的离子方程式是 。
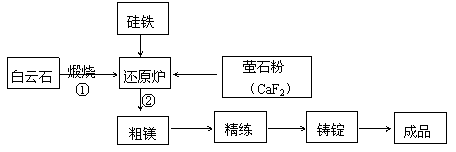
23.(10分)金属镁与镁合金在航空、汽车制造和电子工业等领域具有广泛的用途,金属镁的冶炼有多种方法,其中之一为皮江法。该方法是以白云石(CaCO3·MgCO3)为原料,经高温煅烧生成氧化物(CaO·MgO),氧化物在还原炉中经1200℃真空条件下用硅铁还原生成镁蒸汽(铁在反应前后化合价不变),镁蒸汽经冷凝器冷凝为粗镁,粗镁再经精炼、铸锭得到成品金属镁。反应工艺流程如下图:
(1)在冶炼过程中反应温度对生成金属镁的影响如图:
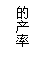

从图中分析,还原反应的反应热△H 0(填“<” “>” “=” )
理由是
(2)还原炉中需要在1200℃真空条件下反应,反应达到平衡时的温度与压强的关系
如下
|
剩余压强mmHg |
760 |
10 |
1 |
0.1 |
|
平衡时的温度℃ |
2370 |
1700 |
1430 |
1235 |
真空条件对制备金属镁来讲,可以达到的目的是:
① ②
(3)含镁矿物常见的有菱镁矿(MgCO3)、白云石和光卤石(KCl·MgCl2·6H2O)其中KCl·MgCl2·6H2O属于
(4)写出下列反应的方程式
①煅烧白云石
②CaO·MgO与Si的反应
22.(9分)有常见A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子多一个。甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如图:

(1)写出C元素的原子结构示意图
(2)用离子方程式解释乙溶液呈酸性的原因 ;丙溶液呈碱性的原因
(3)写出下列反应的离子方程式:
①少量的丙溶液滴加到乙溶液中 ②己溶液+丙溶液→丁
21.(13分)某化学兴趣小组的同学受带火星的木条分别在空气和O2中的现象区别的启发,设计了对NO2气体能否支持燃烧的实验方案
(1)甲组同学设计的实验方案为:向烧瓶中加入适量的浓硝酸并加热,当烧瓶中有红棕色气体产生后,将带火星的木条伸入烧瓶中,发现木条熄灭,由此他们得出NO2不能支持燃烧的结论,甲组同学所得出的结论一定正确吗?请你说明理由
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,如2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ ; 2AgNO3 = 2Ag + 2NO2↑ + O2↑
他们根据此原理设计了如下图的装置(加热、夹持仪器未画出)并分别用Cu(NO3)2、
 AgNO3进行实验,
AgNO3进行实验,
试验中发现,当红棕色的气体进入集气瓶后,带火的木炭均能复燃,
乙组同学由此得出NO2能支持燃烧的结论,指导老师认为乙组的两实验中,有
一个实验所得结论是不可靠的,你认为该实验中所选用的反应物是
结论不可靠的原因是 ;运用该实验装置进行实验的缺陷是
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2)来探究NO2能否支持燃烧的实验。
丙组同学制取NO2的化学方程式是
下图是该组同学设计的制取并收集较纯净的NO2气体的实验装置,请在方框图中将该
装置补充完整,并注明补充装置中所用的试剂及用量。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com