
题目列表(包括答案和解析)
7、同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A V1>V2>V3 B V1>V3>V2 C V2>V3>V1 D V3>V1>V2
6.已知:2Fe3+ + Cu → Cu2+ +2Fe2+ 。现有含有Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液,且Fe与稀硝酸反应的还原产物仅为NO。若向其中逐渐加入铁粉,溶液中Fe2+ 浓度和加入铁粉的物质的量之间关系如下图所示。则稀溶液中Fe(NO3)3、
Cu(NO3)2、HNO3物质的量浓度之比为
A.1︰1︰1 B.1︰3︰1 C.3︰3︰8 D.1︰1︰4
5. t℃时,甲、乙两个烧杯中各盛有100g(密度为1.10g/cm3)相同浓度的KCl溶液。现将甲烧杯中的溶液蒸发掉35.0g H2O,恢复到t℃时,析出KCl固体5.0g;乙烧杯中的溶液蒸发掉45.0gH2O,恢复到t℃时,析出KCl固体10.0g。下列说法正确的是
A.原溶液的质量分数为20% B.t℃时,KCl的溶解度为50.0g
C.原溶液的物质的量浓度为3.0mol/L
 D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
D.乙烧杯中剩余KCl溶液的质量分数大于甲烧杯中剩余KCl溶液的质量分数
4、下列金属或氧化物可以完全溶解的是
A、1molZn与含1molHCl的稀溶液共热 B、1molCu与含4molHNO3的浓硝酸
C、1molCu与含2molH2SO4的浓硫酸共热 D、1molMnO2与含4molHCl的浓盐酸共热
3、下列叙述中正确的是
A、CO2分子内含有极性键,所以CO2分子是极性分子
B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C、气态氢化物的稳定性:NH3>PH3>AsH3
D、某非金属元素从游离态变成化合态时,该元素一定被还原
2.最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物 B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体 D.1mol N4气体转变为N2将吸收882kJ热量
1、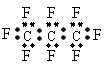 最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是
A、分子中三个碳原子可能处于同一直线上 B、全氟冰烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
29.(12分)在省实验调演活动中,某校几个研究性学习小组的师生对金属镁在空气中燃烧的产物进行探究。
①第一小组同学根据所学知识认为镁在空气中燃烧的产物就是氧化镁。请你用化学方程式表示第一小组同学的观点: ;
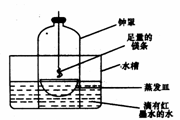
②第二小组同学认为,空气中存在大量的氮气,镁也可能和氮气反应。他们设计了如下装置进行实验:
镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持第二小组同学的观点的实验现象除生成淡黄色固体外还有 ,理由是 ;
③第三小组同学对实验中生成的淡黄色固体产生了兴趣,他们向蒸发皿中的固体滴加少量水,现有刺激性气味的气体产生,淡黄色固体转变成白色。请写出上述过程中发生的化学反应方程式: ,生成淡黄色固体的化学方程式是 ;
④第四小组同学在探究上述实验的基础上又通过查阅资料得知,Al4C3能象淡黄色固体一样,遇水也能剧烈反应。请你写出Al4C3和水反应的化学方程式 。
重庆市垫江师范学校2007届高三化学查漏补缺试题
28.(15分)
Ⅰ(7分)(1)25 ℃时,取0.2 mol·L-1盐酸与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合液中水电离出的c(H+)_________原盐酸中水电离出的c(H+);(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH)=__________ mol·L-1
(2)25 ℃时,如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
Ⅱ.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.70 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应: ;
②R2X2与ZX2反应: 。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
 (4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
(4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
27.. (14分)如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去)
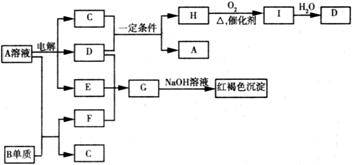
请回答下列问题:(1)写出A的化学式: ; G的化学式: ;
(2) B元素在元素周期表中的位置为: ;
(3)写出电解A溶液的离子方程式: ;
(4) 若向F的溶液中加入足量的NaOH溶液,可观察到的现象 ;
(5)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的负极材料可以是: ;
正极的电极反应是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com