
题目列表(包括答案和解析)
19.(12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次递增。已知A和C,B和D分别位于同主族,且B、D的质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。请回答:
(1)A2B和A2D的沸点较高者为 (填化学式)。
(2)由A、B、C、D四种元素形成的无结晶水的化合物甲的溶液与由A、B、E三元素形成的化合物乙的溶液相互间反应的离子方程式可能: 。
(3)写出由A、B、C三元素所形成的原子个数比为1:1∶1的化合物的电子式 ,其晶体中存在的化学键有 (填化学键名称)。
 (4)NH3·H2O的电离方程式为NH3·H2O NH
(4)NH3·H2O的电离方程式为NH3·H2O NH +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是
。(填a或b)

(5)利用稀有气体化合物,人们实现了许多制备上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe,写出上述反应的化学方程式 。
26.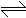 (10分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)
(10分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)
(1)若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答。
(2)若仅已知A=0.8,试求B值的范围。
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示)。
25、 (8分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物质量和产生的气体体积(标况)的关系。试计算:
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(3)当NaOH溶液的体积为180mL ,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(8分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4固体混合物,加热充分反应。如图表示加入的混合物质量和产生的气体体积(标况)的关系。试计算:
(1)NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标况)为多少升?
(3)当NaOH溶液的体积为180mL ,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标况)为多少升?
24.(10分) 已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
试回答下列:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是 ;
(2)B的电子式为 ;
(3)写出反应②的化学方程式 ;
(4)写出反应①、⑥的离子方程式
① ;
⑥ 。
23.(10分)如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。

⑴X的化学式为 ;F的电子式为 。
⑵反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
⑶若向100 mL 盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________________________。(假设溶液体积不变)
22.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
⑴C、D组成的常见化合物,其水溶液呈碱性,原因是 ____________(用离子方程式表示)。写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 ___________。
⑵D的单质能跟C的最高价氧化物水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式:
_ ________________________。
⑶A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 。
21.(12分)碱式碳酸镁有多种不同的组成,如: Mg2(OH)2CO3、Mg4(OH)2(CO3)3、Mg5(OH)2(CO3)4等。某研究性学习小组同学为确定某种碱式碳酸镁的组成,设计下图所示的实验装置。

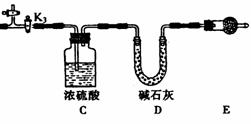
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________。E处干燥管盛放的药品是_______________________________。
②称取碱式碳酸镁样品ml g,并将其放入硬质玻璃管中,称量:装浓硫酸的洗气瓶C的质量为m2 g,装碱石灰的U型管D的质量为m3 g。
③打开活塞_________________,关闭_________________,缓缓鼓入空气数分钟。
④关闭活塞_________________,打开_________________,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,称得洗气瓶C的质量为m4 g:U型管D的质量为m5 g.
实验测得数据如下:ml=31 g,m2=87.6 g,m3=74.7 g,m4=89.4 g,m5=87.9 g。
计算推导:该碱式碳酸镁的化学式为_________________________________。
(2)关于该实验方案,以下说法你认为正确的是________________________(填字母)。
A.硬质玻璃管中有水凝结对测定结果有较大影响
B.不称量碱式碳酸镁样品的质量无法确定碱式碳酸镁的组成
C.该实验装置也可用于确定天然碱[a Na2CO3·b NaHCO3·c H2O(a、b、c为正整数)]的化学组成。
20.(14分) 为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程。某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸 ②如图塞好疏松的棉花和铜丝 ③一段时间后,使铜丝浸入过量的硝酸反应 ④慢慢向试管底部推入棉花,可见明显现象。 第①步放入大理石的作用是:
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞, NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色。但按他的方法实际操作的丙同学发现此法至少存在两个问题:①当酸液加到浸没分液漏斗下端管口以后,会
而使后面的实验无法观察到预期现象。 ②反应开始后,因为随着NO的体积增加,
②反应开始后,因为随着NO的体积增加,
影响铜丝与硝酸的继续反应。
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在答题卷相应图上(如左)补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来。为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达 ,设定有条件精确称量,还需要的数据是
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考。已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2=NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO=2NaNO2+H2O,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
19、(14分)(1)以下各种尾气吸收装置中,适合于吸收HCl气体,而且能防止倒吸的有__________
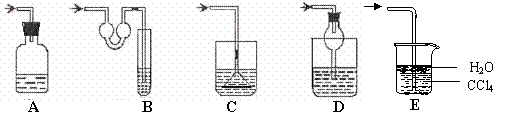

(2)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(3)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ;
②下图是酸式滴定管中液面在滴定前后的读数:


c(NaOH)= ;
③若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
18、某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2 g |
15.7 g |
27.6 g |
|
V(CO2)(标况) |
2.24 L |
3.36 L |
3.36 L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0 mol·L-1
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g时盐酸过量
D.15.7 g混合物恰好与盐酸完全反应
第II卷(非选择题,共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com