
题目列表(包括答案和解析)
8.在标准状况下,若V L甲烷中含有的氢原子个数为n,则阿伏加德罗常数的数值可表示为 ( )
A.Vn/22.4 B.22.4n/V
C.Vn/5.6 D.5.6n/V
解析:设阿伏加德罗常数为NA,则依题意,可得×4NA=n,即NA=
mol-1.
答案:D
7.有一真空瓶的质量为W1 g,向该瓶充入氧气后的质量为W2 g,在相同条件下充入某一单质气体,其质量为W3 g,则此单质气体的摩尔质量为 ( )
A.×32 B.×32
C.×32 g/mol D.×32 g/mol
解析:根据题意,该气体物质的量与氧气相同,有如下关系:=,即可确定答案.
答案:C
6.某溶液中大量存在以下五种离子:NO、SO、Fe3+、H+、M,其物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为 ( )
A.Fe2+ B.Mg2+
C.CO D.Ba2+
解析:根据电荷守恒可知M为+2价的阳离子,排除CO,由于原溶液中存在SO,根据离子共存知,其中不可能含有Ba2+,又因原溶液中含有NO和H+,使溶液具有强氧化性,所以原溶液中不可能存在Fe2+.
答案:B
5.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol/L和b mol/L.则a与b的关系为
( )
A.a=b B.a=2b
C.2a=b D.a=5b
解析:n(CuO)∶n(MgO)=∶=∶=1∶2,体积相同时,物质的量的比等于物质的量浓度的比,所以==,即2a=b,故选C.
答案:C
4.某氯化镁溶液的密度为1.18 g/cm3,其中镁离子的质量分数为5.1%,300 mL该溶液中氯离子的物质的量约等于 ( )
A.0.37 mol B.0.63 mol
C.0.74 mol D.1.5 mol
解析:n(Mg2+)==0.75 mol,
在MgCl2溶液中,Mg2+与Cl-的物质的量之比为1∶2,则n(Cl-)=2n(Mg2+)=2×0.75 mol=1.5 mol.
答案:D
3.(2010·汕头二模)只给出下列甲和乙中对应的量,不能求出物质的量的是 ( )
|
|
A |
B |
C |
D |
|
甲 |
物质的 粒子数 |
标准状况下的 气体摩尔体积 |
固体的 体积 |
溶液中溶质的 物质的量浓度 |
|
乙 |
阿伏加德 罗常数 |
标准状况下 的气体体积 |
固体的 密度 |
溶液的体积 |
解析:根据n=、n=、nB=cBV可知,A、B、D中都能求出物质的量.
答案:C
2.(2009·浙江高考)用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA
B.1 mol乙烷分子含有8NA个共价键
C.58.5 g的氯化钠固体中含有NA个氯化钠分子
D.在1 L 0.1 mol/L碳酸钠溶液中,阴离子总数大于0.1NA
解析:A项,0.25 mol NO与0.25 mol O2将反应生成0.25 mol NO2,剩余O2 0.125 mol,不考虑NO2转化N2O4,分子总数应为0.375NA;B项,乙烷的结构式为,
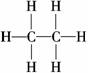
1 mol分子中含7NA个共价键;C项,NaCl为 离子晶体,
无分子;D项 正确,因CO水解使得阴离子数增加.
答案:D
1.(2010·安庆模拟)设NA为阿伏加德罗常数的值,下列叙述中正确的是 ( )
A.常温常压下,3.2 g O3所含电子数为1.2 NA
B.标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA
C.标准状况下,11.2 L NO与11.2 L O2混合所含原子数为2NA
D.将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+
解析:3.2 g O3含0.2 NA个氧原子,所含电子数为1.6 NA,A不正确;标准状况下,CCl4是液体,B不正确;NO、O2都是双原子分子,二者物质的量和为1 mol,故所含原子数为2NA,C正确;因Fe3+水解,Fe3+的数目应小于0.1 NA,D不正确.
答案:C
14.(14分)(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,反应的离子方程式为 .
反应后得到棕黄色的FeCl3溶液.用此溶液做以下实验:
(2)取少量溶液置于试管中,滴入NaOH溶液,看到有红褐色沉淀生成,反应的离子方程式为 .
(3)在小烧杯中加入25 mL蒸馏水,加热至沸腾后,向沸水中加入2 mL FeCl3饱和溶液,继续煮沸至溶液呈 色,即可制得Fe(OH)3胶体.
(4)另取一小烧杯也加入25 mL蒸馏水后,向烧杯中也加入2 mL FeCl3饱和溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯中会产生丁达尔效应.此实验可以区别 .
(5)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀盐酸,边滴边振荡,可以看到的现象是
,
此变化的离子方程式为 .
(6)已知明矾能净水,理由是
.
解析:(1)Fe2O3作为一种典型的碱性氧化物,可溶于稀盐酸,化学反应方程式为:Fe2O3+6HCl===2FeCl3+3H2O.
(2)FeCl3溶液与NaOH溶液发生如下反应:FeCl3+3NaOH===Fe(OH)3↓+3NaCl.
(3)Fe(OH)3胶体呈红褐色.
(4)甲为FeCl3溶液,乙为Fe(OH)3胶体,二者可用丁达尔效应区别,即用激光笔照射两液体,可在Fe(OH)3胶体中看到一条光亮的通路.
(5)向Fe(OH)3胶体中加入稀盐酸,首先可看到有Fe(OH)3沉淀生成,此时发生了胶体的聚沉,再加稀盐酸,可看到Fe(OH)3逐渐溶解,生成棕黄色溶液,离子方程式为:Fe(OH)3+3H+===Fe3++3H2O.
(6)明矾净水,是因Al3+水解生成Al(OH)3胶体,能吸附水中的悬浮物,使之沉淀,从而达到净水的目的.
答案:(1)Fe2O3+6H+===2Fe3++3H2O
(2)Fe3++3OH-===Fe(OH)3↓
(3)红褐 (4)乙 溶液和胶体
(5)首先得到红褐色沉淀,最终又得到棕黄色溶液
Fe(OH)3+3H+===Fe3++3H2O
(6)明矾溶于水后,Al3+水解生成Al(OH)3胶体,它具有较强的吸附能力,可吸附水中的杂质而使之聚沉
13.(9分)已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按下图进行反应.
回答下列问题:

(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是 .
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的 ,理由是 .
(3)如果E溶液是一种强酸,则E的化学式为 .
解析:符合框图关系的A可能为:Mg、Al、Zn(不能为Fe),B为Cl2,C为H2.
答案:(1)③⑤ (2)A 金属单质在室温下不可能为气态物质 (3)HCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com