
题目列表(包括答案和解析)
18.(12分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
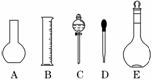
(2)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度 0.1 mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 0.1 mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为 mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是
.
解析:(1)五种仪器分别为烧瓶、量筒、分液漏斗、胶头滴管、容量瓶,配制上述溶液肯定不需要烧瓶和分液漏斗,还需要烧杯、玻璃棒.
(2)容量瓶不能用于贮存、加热溶液,它只有一个刻度线,也不能测量容量瓶规格以下的任意体积的液体.
(3)因无450 mL的容量瓶,配制NaOH溶液只能用500 mL的容量瓶,m(NaOH)=c·V·M=0.1 mol/L×0.5 L×40 g/mol=2.0 g,定容仰视刻度线,造成加水较多,浓度偏低,洒落溶液会造成溶液浓度偏低.
(4)由稀释前后物质的量相等,V(浓)==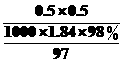 L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻
L= L=13.6 mL,选用15 mL的量筒最好,误差小.稀释时将浓硫酸沿器壁缓缓倒入水中,并用玻
璃棒不断搅拌.
答案:(1)A、C 烧杯、玻璃棒 (2)B、C、E、F
(3)2.0 小于 小于
(4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
17.(7分)(1)将40 g NaOH溶于水,配成250 mL溶液甲,甲的浓度为 mol/L(将正确选项的标号填入空格,下同).将50 mL甲加水稀释至100 mL后,得溶液乙,乙的浓度为 mol/L.将10 mL乙溶液与质量分数为9%、密度为1.11 g/cm3的NaOH溶液10 mL混合,该混合溶液丙的浓度为 mol/L(忽略溶液体积变化).混合溶液丙能与 mL 0.5 mol/L的盐酸恰好完全中和.
|
选项 |
|
|
|
|
A.4 |
B.1 |
C.2 |
D.90 |
|
E.45 |
F.35 |
G.4 .25 |
H.2.25 |
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是 ,X的相对原子质量是 .
解析:(1)n(NaOH)==1 mol,
c(甲)==4 mol/L;
c(乙)==2 mol/L;
c(丙)=
=2.25mol/L,丙中NaOH的物质的量等于HCl的物质的量,n(HCl)=2.25 mol/L×0.02 L=0.045 mol,
V[HCl(aq)]==0.09 L(即90 mL).
(2)n(Na2X)=n(Na+)=×0.4 mol=0.2 mol,M(Na2X)==62 g/mol,M(X)=62 g/mol-2×23 g/mol=16 g/mol,
因此,X的相对原子质量为16.
答案:(1)A C H D (2)62 g/mol 16
16.对于1 mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化) ( )
A.将标准状况下22.4 L氨气溶于1 L水中配成溶液,即可得1 mol/L的氨水
B.1 mol/L的氨水的质量分数小于1.7%
C.将1 mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol/L
D.将1 mol/L的氨水与3 mol/L的氨水等质量混合后,所得氨水的物质的量浓度为2 mol/L
解析:A项,因氨水以起始溶入的氨为溶质,故将1 mol氨溶于水配成1 L溶液,其物质的量浓度为1 mol/L;B项,由物质的量浓度与质量分数的关系,可有以下表达式:=1 mol/L,又由于氨水的密度ρ<1 g/cm3,故w>1.7%;C项,若将1 mol/L的氨水与水等体积混合,所得氨水的浓度为0.5 mol/L,由于氨水密度比水小,则相同质量的氨水的体积比水大,故等质量混合后所得氨水的物质的量浓度大于0.5 mol/L;D项,因氨水的浓度越大,其密度越小,则等质量混合时,3 mol/L的氨水所占体积比1 mol/L的氨水大,故所得氨水的物质的量浓度大于2 mol/L.
答案:C
15.(2010·深圳一调)右图是某硫酸试剂瓶的标签上的部分文字.据
此,下列说法正确的是 ( )
A.该试剂应保存在玻璃试剂瓶中,并用橡胶塞塞紧
B.1 mol Zn与足量的该硫酸反应生成2 g 氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2
mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,
被还原的硫酸的物质的量小于0.46 mol
解析:浓硫酸有腐蚀性,不能用橡胶塞,应用玻璃塞,A错误.浓硫酸具有强氧化性,其还原产物为SO2,B错误.C项设硫酸与水的体积分别为1 mL,混合后浓度为(1.84 g/cm3×1 mL×98%÷98 g/mol)÷0.002 L=9.2 mol/L,但实际混合后溶液密度有变化,其浓度不等于9.2 mol/L,C错误.D中随反应进行,浓硫酸变为稀硫酸时反应停止,被还原的硫酸小于×0.05 L×18.4 mol/L,即小于0.46 mol.
答案:D
14.下列叙述正确的是 ( )
A.与28 g CO具有相同分子数的CO2的质量一定是44 g
B.与V L CO具有相同分子数的CO2的体积一定是V L
C.所含原子数相等的CO与CO2的密度之比为7∶11
D.所含原子数相等的CO与CO2的密度之比为21∶22
解析:A项:根据公式=n=,可列式:=,可判断A项正确.B、C、D都未指明两种气体所处的温度和压强是否相同,所以说法都不正确.
答案:A
|
硫酸化学纯(CP) (500 mL) 品名:硫酸 化学式:H?2SO?4 相对分子质量:98 密度:1.84 g/cm?3 质量分数:98% |
13.某学生配制了100 mL 1 mol/L的硫酸溶液.然后,对溶液浓度做精确测定,且测定过程中一切操作都正确.结果测得溶液的物质的量浓度低于1 mol/L.那么,在配制过程中,下列操作可能导致溶液浓度偏低的是 ( )
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
A.②③④ B.③④
C.①②③ D.①②③④
解析:①量筒用蒸馏水洗净后量取,浓H2SO4被稀释,所取溶质H2SO4偏少,会导致浓度降低.②未洗涤烧杯,溶质H2SO4损失,会导致浓度偏低.③少量溶液流到容量瓶外面,溶质H2SO4损失,会导致浓度偏低.④加水超过了刻度线,马上用胶头滴管吸去多余的水,会损失H2SO4,导致溶液浓度偏低.
答案:D
12.以下仪器,用蒸馏水洗净后便可立即使用而不会对实验结果造成误差的是 ( )
①中和滴定用的锥形瓶 ②中和滴定用的滴定管
③容量瓶 ④配制一定体积、一定物质的量浓度的NaOH溶液,用于称量的小烧杯 ⑤量筒(量取浓H2SO4用)
A.①②⑤ B.①③
C.②④⑤ D.①⑤
解析:中和滴定时锥形瓶中有蒸馏水不会对实验结果产生误差,容量瓶定容时仍会加水至刻度线.
答案:B
11.在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9 g/cm3,这种氨水的物质的量浓度和质量分数分别为 ( )
A.18.4 mol/L 34.7% B.20.4 mol/L 38.5%
C.18.4 mol/L 38.5% D.20.4 mol/L 34.7%
解析:NH3溶于水后虽然大部分生成NH3·H2O,但在计算时,仍以NH3作为氨水中的溶质;气体溶于水后,溶液的体积、密度均发生了改变,计算时应该用溶液质量除以密度求出其体积.设水的体积为1 L,则有:
w=×100%=34.7%
氨水的体积为:
V==1.7 L
故c==18.4 mol/L.
答案:A
10.300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO的物质的量浓度为 ( )
A.0.4 mol/L B.0.3 mol/L
C.0.2 mol/L D.0.1 mol/L
解析:n(Al3+)==0.06 mol,则n(SO)=0.09 mol.加入的Ba(OH)2溶液中含Ba2+ 0.03 mol,反应后剩余SO 0.06 mol,此时溶液的体积为600 mL,因此c(SO)=0.1 mol/L.
答案:D
9.若以w1和w2分别表示浓度为a mol/L和b mol/L氨水的质量分数,且知2a=b,则下列判断正确的是(氨水的密度比纯水的小) ( )
A.2w1=w2 B.2w2=w1
C.w2>2w1 D.w1<w2<2w1
解析:设溶液的体积为V L,密度为ρ g/mL,溶质的摩尔质量为M g/mol,物质的量浓度为c mol/L,由c=得:a=1000ρ1w1/17,b=1000ρ2w2/17,因为2a=b,所以有2ρ1w1=ρ2w2,又氨水的密度比纯水小,且浓度越大,密度越小,所以ρ1>ρ2,代入上式得:2w1<w2.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com