
题目列表(包括答案和解析)
3.下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
1.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的是
A.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
B.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小,可判断不同反应的反应速率的快慢
D.用原子半径数据,可推断某些原子氧化性或还原性的强弱
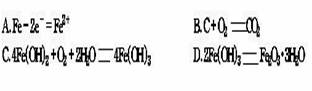
 2.目前,脱氧保鲜剂已广泛应用于食品保鲜、粮食及药材防虫、防霉等领域。含铁脱氧剂是利用铁易氧化的性质,完全吸收包装袋中的氧,从而对包装袋内的物品起到防氧化的作用。当含铁脱氧剂变成红棕色时,脱氧剂失效。含铁脱氧剂的配方见右表。下列反应式中与铁脱氧原理无关的是
2.目前,脱氧保鲜剂已广泛应用于食品保鲜、粮食及药材防虫、防霉等领域。含铁脱氧剂是利用铁易氧化的性质,完全吸收包装袋中的氧,从而对包装袋内的物品起到防氧化的作用。当含铁脱氧剂变成红棕色时,脱氧剂失效。含铁脱氧剂的配方见右表。下列反应式中与铁脱氧原理无关的是
16.某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3 SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ:学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验作者设计这个实验的目的是_________________________________________________________________。
实验Ⅱ:取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是____________________________________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_________________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是_________________________________。
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ。实验Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是_______________________________________________。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①_________________________________②______________________________
高三化学实验复习作业(3)
化学实验方案设计和评价
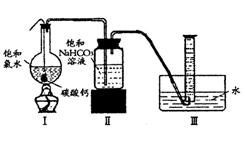
15.某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有能看到浑浊现象。经过思考分析后,该同学改用图二的装置,将气体收集在注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生现象明显比通入CO2快。
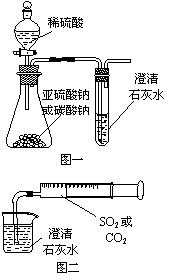 ⑴对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:__________________________________________。
⑴对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是:__________________________________________。
⑵用图二装置实验时,以相同速率通入CO2或SO2,SO2
产生浑浊、澄清的现象比CO2快的原因是______________
________________________________________。
⑶用图一进行SO2与石灰水反应的实验时,从安全角度考虑装置应做何改进?
___________________________________________________。
14、某化学课外活动小组,从化学手册上查得硫酸铜在500 ℃以上按下式分解:CuSO4 CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
CuO+SO2↑+SO3↑+O2↑,便决定设计一验证性实验探索测定反应产生的SO2、SO3和O2的物质的量,并经计算以此确定该条件下CuSO4分解反应方程式中各物质的化学计量数。实验可能用到的仪器如下图所示:
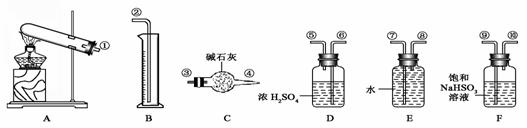
实验测得数据及有关结果如下:
①准确称取6.0 g无水CuSO4;②干燥管总质量在实验结束时增加了2.4 g;③测出量筒中水的体积后,折算成排水的气体,在标准状况下的体积为280 mL;④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其他杂质)。
试回答下列问题:
(1)按装置从左至右的方向,各仪器接口连接顺序为_____________________(填序号)。
(2)装置F的作用是_____________________________________________。
(3)装置D的作用是_____________________________________。
(4)确定装置E的进、出口的原则是:______________。
(5)首先应计算的是物质__________的体积;通过计算,推断出该条件下反应的化学
方程式:__________________________。
(6)该实验设计中,可能给测定带来误差最大的装置是___________________(填代号)。
13、某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
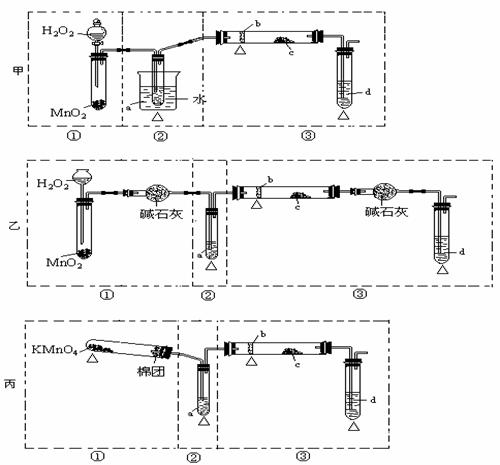
(1)简述三套方案各自的优点
甲:_______________________________________________________
乙:_______________________________________________________
丙:_______________________________________________________
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_____________________(例如甲①,乙②,丙③)
(3)若要保证此实验有较高的效率,还需补充的仪器有________________________。
理由_________________________________________________。
(4)实验中能验证乙醇氧化产物的实验现象是__________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式______________________________。
12、 (I)在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应生成乙醛,资料提示HgSO4遇到H2S等物质会发生催化剂中毒而失去活性。
(I)在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应生成乙醛,资料提示HgSO4遇到H2S等物质会发生催化剂中毒而失去活性。
供选用试剂:块状电石、HgO粉末、浓H2SO4、NaOH溶液、蒸馏水
装置图如下:(夹持装置和热源均已省略)
回答下列问题:
(1)加入药品前,检验装置A气密性的简单操作方法
(2)装置B中盛放的试剂为 ,反应的离子方程式为 。
(3)烧瓶C中应分别直接加入三种试剂,操作方法是 。
(4)E装置的作用是 ,尚需添加的仪器名称及位置 。
(5)该方法制乙醛纯度较高,但在操作中易发生汞中毒,不安全。再设计一种实验室制乙醛的方法,写出反应原理的化学方程式
(II)若用A、B、D装置相连(导管长短、数量可调整)进行苯与溴反应的实验。为验证反应产物,B装置中盛放的试剂为 。
反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢,下列是三个提纯方案: 甲 :①水洗 ②碱洗 ③水洗 ④干燥 乙:①碱洗 ②水洗 ③干燥 ④蒸馏
丙: ①水洗 ②碱洗 ③水洗 ④干燥 ⑤蒸馏
三者中最合理的方案是 。其它方案的不足是 。
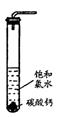
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成
的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,
最简单的方法是
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现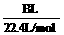 明显小于
明显小于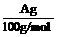 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
;
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是________________ 。
11.(Ⅰ)已知常温下苯酚微溶于水,溶解度为8.2g/100g水,其饱和溶液的物质的量浓度约为0.8mol/L。为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计了如下实验方案:
甲:向两只试管中,分别注入0.8mol/L的乙醇和苯酚溶液3mL,各放入一小块金属钠,观察反应产生H2的速率。
乙:在两只试管中,分别放入1 g乙醇和苯酚晶体,各注入3mL蒸馏水,振荡,得到乙醇溶液和苯酚浊液,再向两试管中逐滴加入5molL的NaOH溶液,观察其中的变化。
(1)苯酚溶液与钠反应的离子方程式为_______________________________________。
(2)对于甲、乙两个实验方案,他们能否达到实验目的?理由各是什么?
________________________________________________________________________。
(Ⅱ)在分析甲、乙两同学实验方案的基础上,丙同学进行了下列对比实验:
在两只试管中,分别放入2 g无水乙醇和苯酚晶体,用约60℃的水浴加热,待苯酚熔成液态后,再向两试管中各放入一小块金属钠。在乙醇中,钠块能与乙醇反应产生气体,约3min后钠块消失,溶液保持澄清;在苯酚中,钠块表面有少量气泡,约2min后出现少量白色悬浮物,10min后白色悬浮物充满苯酚熔融液,振荡后发现钠块尚未完全消失。
(3)丙同学的实验表明,苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其主要原因是________________ ____________________,因此苯酚熔融液和无水乙醇与钠反应的有关事实_________(填“能”或“不能”)作为判断分子里羟基上氢原子哪个更活泼的依据。
(4)请你设计一个探究苯酚和乙醇分子中羟基上氢原子活泼性的实验方案:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少
 量气泡产生,溶液浅黄绿色褪去;
量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是___________________________ ;
 (2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______ ___;
6、(1)醛基 ① ③
(2)② ③
(3)①C6H10O2
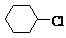 ② A:
② A:
E:CH3COO(CH2)6OOCCH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com