
题目列表(包括答案和解析)
6.下列关于保健食品的叙述不正确的是 ( )
A.强化营养的保健食品可以提高人体的营养水平,增强机体的免疫功能
B.锌能促进生长发育是因为锌在人体内参与18种酶的合成,还能激活80多种酶
的活性
C.保健食品也是食品,所以只需要食用保健食品,就可以满足人体对各种营养素
的需求
D.人在不同生长发育阶段有不同的生理特点和需要,所以不同的年龄人群可选用
不同种类的保健食品
解析:保健食品不同于一般的食品,某种保健食品只偏重于某种营养素,所以只食
用保健食品不能满足人体对各种营养素的需求.
答案:C
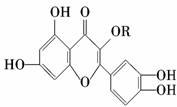
5.(2009·浙江模拟)天然维生素P的结构为 ,存在于
槐树花蕾中,它是一种营养强化剂.关于
维生素P的叙述错误的是 ( )
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1 mol 维生素P可以和4 mol NaOH反应
解析:天然维生素P的结构中,含有两个苯环,中间的六元环是杂环,杂环上含
有一个碳碳双键,可以和溴水反应,苯环上含有4个酚羟基,1 mol 维生素P可
以和4 mol NaOH反应;因为维生素P是有机物,它在有机溶剂中的溶解度比在
水中的溶解度大,因此,可用有机溶剂萃取.
答案:C
4.我国规定,所有销售的食品包装标签配料表上,食品添加剂应使用规定的产品名称
或种类名称,其中甜味剂、防腐剂、着色剂应注明.下图标签注明的添加剂中属于
着色剂的是 ( )
|
①柠檬酸 ②山梨酸钾 ③甜味素 ④菠萝香精
⑤柠檬黄 ⑥日落黄
A.①②⑤ B.②⑤⑥ C.⑤⑥ D.③④
解析:柠檬酸是酸味剂,山梨酸钾是防腐剂,甜味素是甜味剂,菠萝香精是食用香
精.
 答案:C
答案:C
3.人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是 ( )
A.K B.Ca C.Na D.Fe
解析:Ca是人体骨骼的组成元素,Fe是人体血红蛋白的组成元素之一,不要将二
者混淆.
答案:B
2.下列说法正确的是 ( )
A.我国居民的膳食结构是相同的
B.符合口味的食品最有营养,符合个人的膳食结构
C.淀粉、油脂、蛋白质为人体提供热能,所以只要这三种摄入量足够就可以了
D.摄入食物中的营养素种类齐全、数量充足、比例适当且与人体的需要保持平衡
才是合理的膳食结构
解析:不同地区、不同季节,人们所摄入的食物种类有所不同,膳食结构也有差
异,A错误.不同的食物,不同的口味,含有不同的营养素,所以符合口味的食
品,不一定能完全符合个人的膳食结构,B错误.淀粉、油脂、蛋白质为人体提供
热能,但仅摄入这三种物质是不够的,人体还需要维生素、无机盐、水等,C错误.
答案:D
1.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是 ( )
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
解析:A项植物油中含有不饱和的碳碳双键,能与Br2发生加成反应,而使溴的四氯化碳溶液褪色,A不正确.C项葡萄糖中存在醛基与羟基,能发生氧化反应,但不能发生水解反应,C不正确.D项硫酸铜是重金属盐,可以使蛋白质变性,变性是不可逆的,变性后的蛋白质不能重新溶于水,D不正确.
答案:B
22.(8分)(2010·南京模拟)将10 g复盐CuSO4·x(NH4)2SO4·yH2O加到过量的NaOH溶液中,加热;生成的氨用100 mL 0.5 mol/L硫酸全部吸收,多余的硫酸用2 mol/L NaOH溶液中和,用去NaOH溶液25 mL.已知复盐中SO的质量分数为48%,则x= ,y= .
解析:解答时可根据题意首先求得铵根离子的物质的量,根据10 g复盐中SO的质量分数为48%,可求SO的物质的量.根据复盐中阴阳离子所带正、负电荷数相等,可求出Cu2+的物质的量,再根据总质量和已知各部分的物质的量,求出水的物质的量,进而求得各部分物质的量之比.
10 g复盐中n(NH)=2×(0.5 mol/L×0.1 L-2 mol/L×0.025 L×)=0.05 mol
n(SO)==0.05 mol
n(Cu2+)=0.05 mol-0.05 mol×=0.025 mol
n(H2O)=
=0.15 mol
n(CuSO4)∶n[(NH4)2SO4]∶n(H2O)
=0.025∶0.025∶0.15=1∶x∶y
得x=1,y=6
答案:1 6
21. (9分)某研究性学习小组为证明在同温同压下,相同浓度、
(9分)某研究性学习小组为证明在同温同压下,相同浓度、
相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气
的体积相同而反应速率不同,同时测定实验室条件下的气体摩
尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤
如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液.
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端.
④检查装置的气密性,在广口瓶中装满水,按图连接好装置.
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 .
⑥反应结束后,读取量筒内水的体积为 y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管.
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 .
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 .
(4)简述速率不等的原因 ,铜丝不与酸接触的原因是
.
解析:Ⅰ.②根据量取溶液体积的精确度要求可知使用酸式滴定管;⑤比较H2SO4、H2C2O4反应速率可通过观察气泡或完全反应所用时间长短.Ⅱ.(1)配制溶液需要使用特定的仪器(250 mL的容量瓶),定容时需用到胶头滴管.(2)为保证测量数据的准确,应该先将气体冷却到室温,所以应该先进行操作②,然后调整液面使气体压强等于外界大气压,最后正确读数.(3)如丙(量筒)中的液面高于乙的液面,应将丙向下移动.(4)因为H2SO4是强酸、H2C2O4是弱酸,故同浓度的两溶液H2SO4中含氢离子浓度大,反应速率快.若铜丝接触溶液,则构成原电池,使反应速率加快,影响实验结果.
答案:Ⅰ.酸式滴定管 反应所需时间
Ⅱ.(1)250 mL的容量瓶 胶头滴管
(2)②①③ (3)下移丙
(4)氢离子浓度不同 易形成原电池加快反应速率,干扰实验的测定
20.(10分)配制一定物质的量浓度的溶液是一个重要的定量实验.请回答以下问题:
(1)配制浓度为 2 mol/L的NaOH溶液100 mL,用托盘天平称取NaOH固体时,天平读数将 (填写代号,下同).
A.等于8.0 g B.等于8.00 g
C.大于8.0 g D.等于0.2 g
(2)要配制浓度约为2 mol/L的NaOH溶液100 mL,下面的操作正确的是 .
A.称取8 g NaOH固体,放入250 mL烧杯中,用量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加水至刻度线,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,边搅拌边慢慢倒入烧杯中
(3)下列操作会使配制的BaCl2溶液浓度偏低的是 .
A.配制1 L 0.1 mol/L的BaCl2溶液时,将砝码放在左盘上,BaCl2放在右盘上进行称量
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(4)某实验中需2 mol/L的Na2CO3溶液950 mL,配制时应选用的容量瓶的规格为 ,称取Na2CO3的质量为 .
解析:(1)称量NaOH固体时需用小烧杯盛放,故天平读数等于(8.0 g +烧杯质量).(2)注意NaOH溶液的浓度约为2 mol/L,并不是精确配制浓度为2 mol/L的溶液.(3)配制一定物质的量浓度溶液的误差分析要紧扣c=,分析错误操作对n、V的影响.(4)根据容量瓶的常用规格可知,应配制2 mol/L的Na2CO3溶液1000 mL,所需Na2CO3的质量为:1 L×2 mol/L×106 g/mol=212 g.
答案:(1)C (2)AD (3)AC (4)1000 mL 212 g
19.(6分)常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液.
(1)该混合溶液中NaCl的质量分数为 .
(2)该混合溶液中NaCl的物质的量浓度 mol/L.
(3)在1000 g水中需加入 mol氯化钠,才能使其浓度恰好与上述混合溶液浓度相等(保留1位小数).
解析:(1)混合溶液的质量为:20.0 g+30.0 g=50.0 g,混合溶液中溶质的质量为:20.0 g×14%+30.0 g×24%=10.0 g,混合溶液中溶质的质量分数为:×100%=20%.
(2)n(NaCl)=
V(溶液)=
c(NaCl)=
=×
=4.0 mol/L.
(3)×100%=20%
n(NaCl)=4.3 mol.
答案:(1)20% (2)4.0 (3)4.3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com