
题目列表(包括答案和解析)
5.下列物质不能用化合反应制取的是( )
A、CaCO3 B、Fe(OH)3 C、H4SiO4 D、FeCl2
4、下列关于胶体的叙述不正确的是( )
A用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
B 光线透过胶体时胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
C 布朗运动是胶体的性质之一,布朗运动不是胶体稳定的主要原因
D 胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证明胶体属于电解质溶液
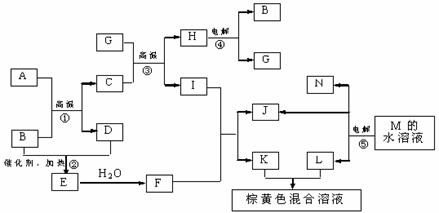
3.ClO2 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2: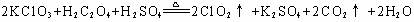 ;下列说法正确的是( )
;下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2 是氧化产物
C.H2C2O4在反应中被还原 D.1 mol KClO3 参加反应有 2 mol 电子转移
2.实验室里做钠跟水反应的实验时,用到的仪器和药品是 ( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤研钵 ⑥烧杯 ⑦坩埚 ⑧石棉网 ⑨玻璃片 ⑩药匙
A.①②③④ B.②③④⑥⑨ C.③④⑧⑨⑩ D.②⑤⑦⑨⑩
1.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
24.为测定某氧化物(化学式为MO)中M是何种金属,做以下实验:称取该氧化物8.0g溶于适量的稀H2SO4中,再配制成250.0mL溶液。取该溶液50mL,用惰性电极进行电解,当刚好电解完时,电极上析出M1.28g.请通过计算回答下列问题:
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)若此电解液在电解后体积为40mL,此溶液的pH为多少?
23.(8分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
 b接 , 接
, 接a。
b接 , 接
, 接a。
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性,证
明最终通入AgNO3 溶液的气体只有一种,乙同学提出在
某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
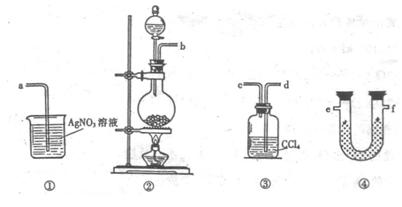
22.(8分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3.Cu(NO3)2.AgNO3。(加热及夹持装置未画出)
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程式: 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
 (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
20.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4 (g)
+ 2H2(g) Si(s) +
4HCl(g)
SiCl4 (g)
+ 2H2(g) Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
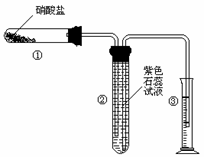
 21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
19.(8分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因___________________________________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?__________,若能,请写出电极反应式,负极__________________,正极_________________。(若不能,后面两空不填)
(3)若电池反应为:Cu + 2H+ = Cu2+ + H2↑,该池属于原电池还是电解池?__________,请写出各电极的电极材料和电解质溶液_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com