
题目列表(包括答案和解析)
25.(6分)pH=1的溶液x中含有三种常见金属阳离子,用x溶液进行如下实验:
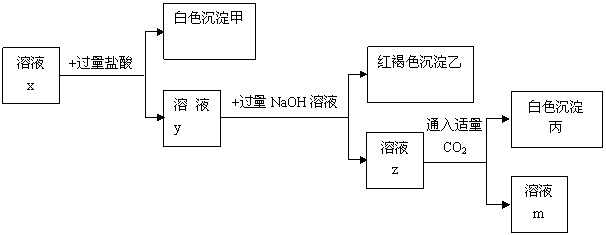
(1)根据有白色沉淀甲生成,可判断x溶液中有阳离子 ,阴离子 。
(2)综合分析有红褐色沉淀乙生成, (填“能”或“不能”)确定x溶液中的一种金属阳离子,理由是
。
(3) 根据有白色沉淀丙生成,可判断x溶液中可能有阳离子 。
24.(12分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号 Y Z
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
23.(13分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
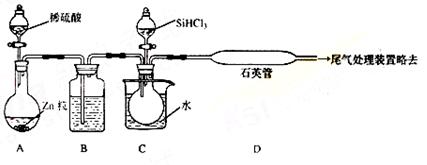
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
三推断题(共三小题26分)
22.(5分)铝及其化合物在生活中有着广泛应用。在我国南方某些地区,当地居民常采用往水中加明矾的方法来处理水中的悬浮杂质。其原理为
。明矾处理后的水中含有较多的阴离子为 ;写出用化学方法验证水中含有这种阴离子的操作和现象: 。
21.(3分)下列实验中所选用的仪器或操作以及结论不合理的是
A.用托盘天平称量11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E. 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
F. 向某溶液中先通Cl2再滴加KSCN溶液时溶液变红,证明该溶液一定含有Fe2+
20.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是 ( )
A.硫酸铜溶液的PH B.溶液中溶质的质量分数
C.硫酸铜的溶解度 D.溶液中Cu2+的数目
选择题答案栏:(每题2分共40分)
 2006-2007届河东三中高三化学期中考试模拟试题
2006-2007届河东三中高三化学期中考试模拟试题
第Ⅱ卷(非选择题共60分)
二实验题(共21分)
19.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是: ( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打;
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显现象的是小苏打;
C.用两只玻璃杯分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是小苏打 ;
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打;
18.某结晶水合物化学式为R·nH2O,其式量为M。 25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是( )
 A.25℃时R的溶解度为:
A.25℃时R的溶解度为: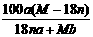 g
g
B.饱和溶液溶质的质量分数为: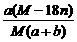 %
%
C.饱和溶液物质的量浓度为: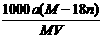 mol·L-1
mol·L-1
D.饱和溶液的密度为: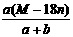 g·mL-1
g·mL-1
17.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
|
|
① |
② |
③ |
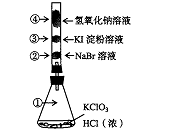 ④ ④ |
|
A |
黄绿色 |
橙色 |
蓝色 |
白色 |
|
B |
无色 |
橙色 |
紫色 |
白色 |
|
C |
黄绿色 |
橙色 |
蓝色 |
无色 |
|
D |
黄绿色 |
无色 |
紫色 |
白色 |
16.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com