
题目列表(包括答案和解析)
(二)启普发生器类

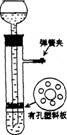
二)固+液体(不加热):适用于制CO2、C2H2、H2 、H2S(SO2、NO2、NO课本没有制法)
|
|
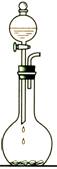

一)固+固(加热):适用于制O2、NH3、(CH4课本没有)
|

2、操作顺序
装置连接→气密性检查→装固体药品→加液体药品→气体制取
|

|

通常有毒和有污染的尾气必须适当处理。常用经典仪器有:





a b c d e
a用于NaOH吸收氯气、CO2;硫酸铜吸收H2S(气体溶解或反应速度不很快,不易引起倒吸);
b用于收集少量气体然后处理;c、d收集极易溶且溶解很快的气体。如HCl、HBr、NH3等;其中d 吸收量少。e用于处理难以吸收(有毒)且可燃的气体。如H2、CO等。
实验装置总装思路
1、装置的安装顺序

二)排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)
(1)向上排空气法:式量大于29的气体。如O2、CO2、SO2、H2S、Cl2、NO2(只用排空气)、HCl等;典型装置是b。
(2)向下排空气法:式量小于29的气体。如H2、CH4、NH3等;典型装置是c。




a b向上排空气法 c向下排空气法 d
练习:(发散思维)
1、下列装置也能用于收集气体,试根据气体的流向判断收集气体的种类。


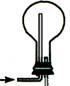



2、排水法收集的气体和排气法收集的气体纯度有何不同?
3、某些气体要求非常干燥,则收集前后都要干燥,如何组装仪器?
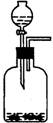
一)排液法:难溶或微溶于水且不与水发生化学反应的气体。例如:H2、O2、CO、CH4、NO(只能用排液法收集)、CH2=CH2、CH≡CH等。注意:Cl2不用排水法收集,但可用排饱和食盐水收集,CO2可以用排饱和NaHCO3收集。排液法的典型仪器是a,注意导管只能伸入集气瓶内少许。
根据气体溶解性(分子极性)和密度(相对分子量,与29比较)不同,把气体的收集方法分为排液法(常为排水法)和排气法(常为排空气法)。装置图见下:
27.计算题(13分)
有四种质量比可能相同或不同的镁铝合金样品①、②、③、④。甲、乙、丙、丁四位同学各取一种样品,进行下列实验,求合金中镁的质量分数。
(1)甲同学取样品①m1g和过量的氢氧化钠溶液反应,然后过滤,再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体m1g则合金中镁的质量分数是 。
(2)乙同学取样品②m2g和足量的盐酸反应,然后滴加过量的氢氧化钠溶液,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体m2g,则合金中镁的质量分数是 。
(3)丙取样品m3g与足量的稀硫酸反应,发现固体完全溶解,在标准状况下得到气体VL,则m3的取值范围是 。
(4)丁取不同质量的样品④分别和30mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下表所示:
|
实验序号 |
a |
b |
c |
|
合金质量(mg) |
510 |
765 |
918 |
|
气体体积(mL) |
560 |
672 |
672 |
分析上表数据后填空:
①a中的盐酸 c中的盐酸 (填“过量”还是“不足量” )
②盐酸的物质的量浓度为 合金中的镁与铝的物质的量比为 镁的质量分数为 。
③在c组实验之后,还需向容器中加入1.00mol/L 的氢氧化钠溶液 才能使合金中的铝恰好完全溶解?
26.(8分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。W是由两种短周期元素组成,其与水的反应可类比电石与水的反应。乙通常是一种红棕色粉末。G为白色胶状沉淀。W、G、H、I三种物质中都含有同一种短周期金属元素。A在常温下为气态,与氧气完全反应时的体积比是1∶2。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:


⑴ B的电子式为 ,I原子的结构示意图______________。
⑵据上述转化关系图C→E、D→F、E→F、I→F、I→E、A→B 等反应按要求写出下列反应方程式。
非金属元素之间的置换反应_______________________________________;
金属单质制备非金属单质的反应___________________________________;
⑶ 写出W和水反应的化学方程式__________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com