
题目列表(包括答案和解析)
4.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.X和Y可属于同一周期,也可属于两个不同周期
B.若Y的原子序数为n,X的原子序数一定是n±4
C.XY3晶体一定是离子晶体
D.X和Y一定不属于同一主族
3.下列化学用语表示错误的是 ( )
A.次氯酸电子式: B.羟基电子式:
B.羟基电子式:
C.镁离子结构示意图: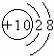 D.氨分子空间结构:
D.氨分子空间结构:
2.有aXn-和bYm+两种离子,其电子层结构相同。下列关系式或化学式正确的是( )
A.a-n=b+m B. a-m=b-n
C.氧化物为YOm D.氢化物为HnX或XHn
1.某元素构成的双原子的单质分子共有三种,其相对原子质量分别为:70、72、74,已知此三种单质的物质的量之比为1:1:1。则有关该元素及其单质等的说法正确的是( )
A.该元素有三种同位素
B.该由元素形成的单质的平均相对分子质量一定为72
C.如果用X表示该元素,则一定有36X这种核素
D.质量数为37的同位素占原子总数的
24.为测定某氧化物(化学式为MO)中M是何种金属,做以下实验:称取该氧化物8.0g溶于适量的稀H2SO4中,再配制成250.0mL溶液。取该溶液50mL,用惰性电极进行电解,当刚好电解完时,电极上析出M1.28g.请通过计算回答下列问题:
(1)M是什么金属?
(2)电解过程中,导线上流过的电子个数是多少?
(3)若此电解液在电解后体积为40mL,此溶液的pH为多少?
23.(8分)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
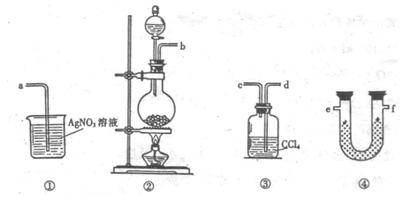
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
 b接 , 接
, 接a。
b接 , 接
, 接a。
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3
溶液中的气体只有一种。为了确保实验结论的可靠性,证
明最终通入AgNO3 溶液的气体只有一种,乙同学提出在
某两个装置之间再加装置⑤。你认为装置⑤应加在 之间(填装置序号)。瓶中可以放入 。
22.(8分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3.Cu(NO3)2.AgNO3。(加热及夹持装置未画出)
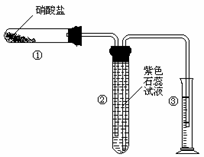
(1)甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程式: 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,英才剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
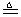 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
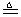 (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明
由: ;
请你设计一个简单的实验证明你的结论是正确的: ;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
20.(8分)通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低Y(填>或<=SiC______ Si; SiCl4 ______ SiO2
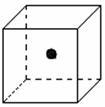 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
 SiCl4 (g)
+ 2H2(g) Si(s) +
4HCl(g)
SiCl4 (g)
+ 2H2(g) Si(s) +
4HCl(g)
该反应的反应热△H = ___________ KJ/mol
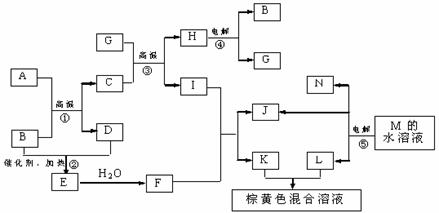 21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
21.(8分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式或离子方程式:
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出反应①所使用设备的名称_________________________________
19.(8分)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。请说明原因___________________________________________________________________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池?__________,若能,请写出电极反应式,负极__________________,正极_________________。(若不能,后面两空不填)
(3)若电池反应为:Cu + 2H+ = Cu2+ + H2↑,该池属于原电池还是电解池?__________,请写出各电极的电极材料和电解质溶液_________________________________。
18.(8分)为防止碘缺乏病,Y通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是________________________________________,若要确认食盐中还含有K+,方法是______________________________________________________________。
(2)工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是____________________________,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com