
题目列表(包括答案和解析)
17.⑴A、 ,D、 ,F、 ,J、 ,K、
⑵①
②
⑶
23.(10分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
江苏省兴化中学2006-2007高三第一轮复习单元测试
化学试卷(物质结构 元素周期律 晶体结构)答题纸
姓名 学号 班级 成绩
22.(12分)1183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
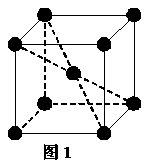
(1)在1183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
(2)纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1183 K以下与1183 K以上之比)___________。
(3)转变温度前后两者的密度比(1183 K以下与1183 K以上之比)_____________。(均可用根号表示)
21.(22分)已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。试回答:
(1)写出下列元素的元素符号
X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式 。
(5)将9g单质Y在足量W单质中燃烧,所得气体通入lL lmol·L-1NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是 。
20.(6分)某-2价元素A的气态氢化物含氢的质量分数为5.88%,0.9gB元素的单质和足量盐酸反应,生成了BCl3和1.12LH2(标准状况),在C、B化合物生成的盐的水溶液中,滴加AgNO3溶液,生成了不溶于稀硝酸的白色沉淀,则A、B、C三元素分别为 、 、 。
19.(12分)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目和。人们曾采用过乙醚、NH3、CH3Cl等做致冷剂,但它们不是有毒就是易燃,于是科学家根据元素性质的递变规律来开发新的致冷剂。
根据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期 > >H2O>HF;
第三周期SiH4>PH3> > 。
(2)化合物的毒性:PH3>NH3 H2S H2O。
CS2 CO2 CCl4 CF4(选填>或<)。
于是科学家开始把注意力集中到F、Cl的化合物上。
(3)已知CCl4 的沸点为76.8℃,CF4的沸点为-128℃,新致冷剂的沸点范畴介于其间。经过长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了。其它类似的还可以是 。
(4)然而,这种致冷剂造成了当今的某一环境问题是 。
18.(8分)水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键相互连接成庞大的分子晶体一次,其结构示意图如图所示
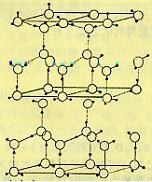
⑴1mol冰中有 mol“氢键”
⑵水分子可电离生成两种含有相同电子数的微粒,其电离方程式为: 。
⑶在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德瓦尔斯力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是 kJ•mol-1
⑷用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是______________________________________________________________
________________________________________________________________________。
17.(16分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
|
粒子代码 |
a |
I |
e |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:请填写下列空白:
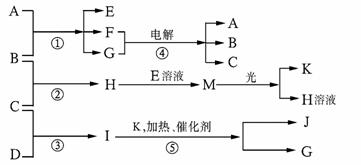
(1)写出下列物质的化学式:
A、 D、 F、____________________
J、 K、
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
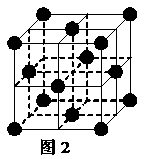
16.高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是( )
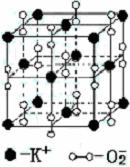
A.超氧化钾的化学式为KO2,每晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
15.下列各组关系比较都正确的是( )
A.微粒半径:K+>Na+>Mg2+>Ba2+ F>O>S>S2-
B.密度:Li<Na<K<Rb F2<Cl2<Br2<I2
C.溶沸点:Li>Na>K>Rb SiO2>NaCl>Na
D.热稳定性:SnH4>GeH4>SiH4>CH4 H2O>NH3>PH3>SiH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com