
题目列表(包括答案和解析)
28.(3分)
下列实验或操作不合理的是
①用FeCl3溶液鉴别乙醇溶液和苯酚溶液
②用溴水检验汽油中是否含有不饱和脂肪烃
③浓硫酸不慎沾到皮肤上,立即用大量水冲洗
④用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
⑤仅用蒸馏水鉴别蔗糖、硫酸铜粉末、碳酸钙粉末
⑥用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH
⑦配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
⑧在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
A.①③⑤⑥ B.③④⑦⑧ C.②④⑤⑧ D.①③④⑦
27.(16分)
一种名为“苹果醋(ACV)”的浓缩饮料多年来风靡全美。ACV是一种由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料的主要酸性物质,分离提纯后对苹果酸的分析如下:
⑴其相对分子质量不超过140;
⑵元素分析证明仅含C、H、O三种元素,各元素的质量分数为 C:35.82%,H:4.48%,其余为O元素;
⑶0.001mol苹果酸与足量NaHCO3反应放出44.8mLCO2,若等量该酸与足量金属Na在一定条件下充分反应则放出33.6mLH2(气体体积均已经折算为标准状况);
⑷结构分析表明,苹果酸中所有碳原子在一条主链上。
回答下列问题:
①苹果酸的分子式为: ;
②写出苹果酸在一定条件下分子内脱水得到的链状产物的结构简式: ,该产物中含有的官能团的名称是: ,该反应的类型属于: ;
苹果酸在一定条件下进行分子内脱水时是否还能得到其他可能的产物,有的话请写出其产物的任意一种结构简式,没有其他产物则此问不填:
;
③写出苹果酸一定条件下与足量Na反应的化学方程式:
;
④写出苹果酸与碳酸氢钠溶液反应的化学方程式:
。
26.(10分)
在一定条件下,N2和H2发生如下反应:
N2(g)+3H2(g) 2NH3(g);△H=-92.4kJ/mol
2NH3(g);△H=-92.4kJ/mol
(1)该反应中△H的含义是(填序号): 。
①该反应达到平衡时放出的热量
②该反应达到平衡时吸收的热量
③该条件下,N2与H2反应生成2molNH3时放出的热量
④该条件下,N2与H2反应生成2molNH3时吸收的热量
 (2)达到平衡后,在其他条件不变的情况下降低温度,H2的转化率_________________,化学反应速度_______________(填“增大”、“减小”或“不变”)。
(2)达到平衡后,在其他条件不变的情况下降低温度,H2的转化率_________________,化学反应速度_______________(填“增大”、“减小”或“不变”)。
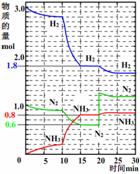
(3) 500℃时,在一密闭容器中,将N2和H2混合,反应过程中N2、H2、NH3物质的量变化如图,反应处于平衡状态的时间是: 。
(4)据图判断,反应进行至15 min时,NH3的体积分数为:
(保留到小数点后2位);
反应进行至20 min时,曲线发生变化的原因可能是:
(用文字表达);
10 min到15 min时曲线变化的原因可能是_________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加NH3的物质的量
25.(20分)
下表中的实线表示元素周期表的部分边界。①-⑧分别表示元素周期表中对应位置的元素。

⑴请在表中用实线补全元素周期表边界。
⑵元素周期表体现了元素周期律,元素周期律的本质是 。
⑶元素③④⑤⑥的原子半径由大到小的顺序是: 。
元素⑤、⑥的最高价氧化物对应的水化物的酸性强弱为:________>________(用化学式表示)。
⑷元素③⑦⑧的氢化物的沸点由高到低的顺序为: (用化学式表示)。
⑸元素①的氢化物的电子式为_______,该分子属于(填“极性”或“非极性”) 分子。
⑹元素⑤在生产生活中有重要用途。写出工业制取其单质的化学方程式: 。
元素⑤与⑦形成的化合物有净水作用,写出其与水作用的离子方程式:
。
⑺元素④与⑦形成的化合物是一种重要的工业原料,写出工业电解其水溶液时的离子方程式:
。
⑻已知一定条件下,1mol ⑥的固态单质在②的单质中充分反应放热297kJ。写出此条件下该反应的热化学方程式: 。
24.(4分)
将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或H2、CO等可燃性气体)和O2构成燃料电池,则通入甲烷气体的极是原电池的 极;通入O2的极为原电池的 极,该极的电极反应式为 。
23.(4分)
⑴写出镁在CO2中燃烧的化学方程式: 。
⑵利用上述原理,中国科技大学一个研究组在440℃和800atm条件下,利用Na与CO2作用得到了金刚石,且有望达到宝石级,给天然金刚石开采业带来极大挑战。写出由钠得到金刚石的化学方程式:
。

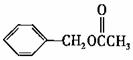
22.乙酸苯甲酯的结构简式如图,它有很多种同分异构体,其中含有酯基的一取代苯结构的同分异构体,除所给出的乙酸苯甲酯外,还有多少种
A.3 B.4 C.5 D.6
第Ⅱ卷 (非选择题 共84分)
21.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO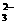 )、c(HCO3¯
)都减少,其方法是
)、c(HCO3¯
)都减少,其方法是
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
20.下列叙述正确的是
A.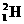 原子中的中子和质子的个数比为2∶1
原子中的中子和质子的个数比为2∶1
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.向0.1mol·L-1 CH3COOH溶液加入少量CH3COONa,CH3COOH的电离平衡正向移动
D.使pH为1的两份相同盐酸的pH均升高为2,需pH为13的NaOH溶液与水的体积比为1∶11
19.在一定温度下,b g KNO3固体能完全溶于水形成(a+b) g溶液,则该温度下,KNO3的溶解度肯定不可能是
A.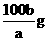 B.
B.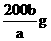
C. D.
D.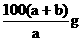
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com