
题目列表(包括答案和解析)
6.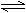 氯水的成分中含Cl2、H2O、HCl、HClO,在与其它物质反应时,有时以Cl2为主,有时以HCl、HClO为主,然后Cl2+H2O HCl+HClO平衡发生移动。则新制氯水与下列溶液的反应中属于前者的是
氯水的成分中含Cl2、H2O、HCl、HClO,在与其它物质反应时,有时以Cl2为主,有时以HCl、HClO为主,然后Cl2+H2O HCl+HClO平衡发生移动。则新制氯水与下列溶液的反应中属于前者的是
①NaHS ②NaOH ③KI ④AgNO3
A.①④ B.①②③ C.①② D.①③
5、将2molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应,排出气体,得到固体。对所得固体进行测定,证明不含有Na2O2 ,则最后所得固体的物质的量为
A 1~2mol之间 B 1~4mol之间 C 2~4mol之间 D 大于4mol
4. 下列关于晶体的说法一定正确的是
下列关于晶体的说法一定正确的是
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.金属晶体的熔点都比分子晶体的熔点高
3.将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2 B.只有O2 C.既有Cl2又有O2 D.只有H2
2.强酸和强碱稀溶液的中和热科表示为
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1
已知:①HCl(aq)+NH3·H2O(aq)=NH4Cl(aq)+H2O(l);△H=a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l);△H=b kJ·mol-1
③HNO3(aq)+KOH(aq)=NaNO3(aq)+H2O(l);△H=c kJ·mol-1
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.c>b>a
1.保护环境是每一个公民的责任。下列做法:
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③推广使用一次性木质筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱。其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
21. (8分)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B、C和E均为2.0摩,设D为x摩、F为y摩.当x、y在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:
1) 若x=1、y=3,反应 (填A.正向进行 B逆向进行C已达平衡状态)。其理由是 。
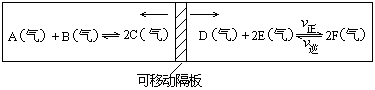
2)
 若
与
, 则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填A相等、B不相等或C不能确定).其理由是:
若
与
, 则在这两种情况下,当反应达平衡时,A的物质的量是否相等? (填A相等、B不相等或C不能确定).其理由是:
。
湖南省宁乡县第一高级中学2007届高三第三次月考化学试题
20.
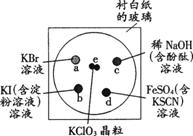 (15分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
(15分)为了减少污染,使实验绿色化,学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻大小的KClO3晶体,盖好表面皿。
打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,试描述反应的现象,并写出相应的化学方程式。
e处:
a处:
b处:
c处:
d处:
19. (15分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
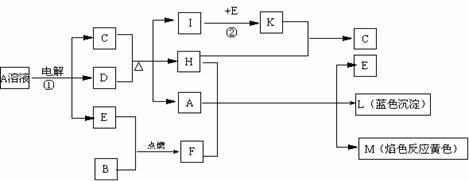
1) H是 (A 极性分子 B 非极性分子)F的电子式: 。
2) 反应①的离子方程式: 。
3) 实验室检验M中含的阴离子的方法是:
|
座位号 |
|
|
|
|
。
4) 每生成0.1molK,反应放出9.83KJ热量,该反应的热化学方程式为:
。
18. (8分)标准状况下,甲、乙、丙各取20mL相同浓度的盐酸,然后分别加入组成完全相同的镁铝合金粉末,得到下表有关数据。请填写相应空白项。
|
|
甲 |
乙 |
丙 |
|
金 属/g |
0.250 |
0.300 |
0.450 |
|
生成气体 /mL |
280 |
313.6 |
313.6 |
|
盐酸的浓度/mol/L |
1)
( ) |
||
|
镁铝的物质的量之比 |
2)
( ) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com