
题目列表(包括答案和解析)
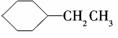
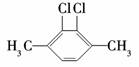
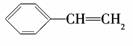
1.下列有机化合物的分类不正确的是 ( )
|
A |
B |
 |
 |
|
苯的同系物 |
芳香族化合物 |
|
C |
D |
 |
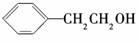 |
|
不饱和烃 |
醇 |
解析:A中没有苯环,所以不是苯的同系物.
答案:A
14.(15分)(1)若某药品质量约为32 g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
|
50 g |
20 g |
20 g |
10 g |
5 g |
|
|
|
|
|
|
(2)配制500 mL 0.1 mol/L Na2CO3溶液,所需Na2CO3的质量为 g,实验时图中所示操作的先后顺序为 (填编号).
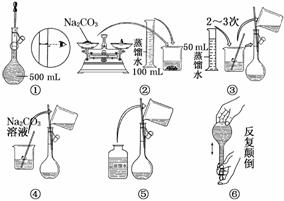
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度 .
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度 .
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度 .
解析:(3)①用量筒取液态溶质,读数时俯视量筒会使所量取液体体积比理论值小,使所配制溶液的浓度偏低;②用量筒量取液体时已经排除残留的部分,故用水洗涤,洗涤液倒入容量瓶,液态溶质偏多,使所配溶液的浓度偏高;③定容摇匀后,即使有少量溶液外流,对所配制溶液的浓度是没有影响的.
答案:(1)
|
50 g |
20 g |
20 g |
10 g |
5 g |
|
↓↑ |
↓ |
↓↑ |
↓ |
↓↑ |
(2)5.3 ②④③⑤①⑥
(3)①偏低 ②偏高 ③无影响
0.0500 mol 0.100 mol 0.0500 mol 0.0500 mol
n(Cl-)=n(NaCl)=0.200 mol+0.0500 mol=0.2500 mol
(3)n(Cl2)∶n(H2)=(0.100 mol+0.0500 mol)∶0.100 mol=3∶2.
答案:(1)10.7% (2)0.2500 (3)3∶2

0.200 mol 0.200 mol 0.200 mol
Cl2 + 2NaOH === NaCl + NaClO+H2O
0.100 mol 0.100 mol 0.200 mol
HCl + NaOH === NaCl+H2O
13.(10分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L 的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol.
(1)原NaOH溶液的质量分数为 .
(2)所得溶液中Cl-的物质的量为 mol.
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= .
解析:(1)原NaOH溶液的质量分数为:
×100%=10.7%
(2)根据题意Cl2过量,化学反应方程式为:
H2 + Cl2 === 2HCl
12.(15分)掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
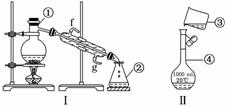
(1)写出下列仪器的名称:
① ,② ,④ .
(2)仪器①-④中,使用时必须检查是否漏水的有 (填序号).
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;冷凝管的进水口是 (填“f”或“g”);现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是:
.
解析:要熟记常见的基本仪器的名称及使用方法,如题目中涉及到的蒸馏烧瓶、冷凝管、锥形瓶、烧杯、容量瓶等.要掌握常见混合物的分离方法和一定体积、一定物质的量浓度溶液的配制等基本实验的操作要领.
答案:(1)蒸馏烧瓶 锥形瓶 1000 mL的容量瓶
(2)④ (3)温度计 分馏 g 未用玻璃棒引流,未采用250 mL的容量瓶
11.(10分)(1)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,则该矿泉水中Mg2+的物质的量浓度为 .
(2)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2∶1,则KCl与CaCl2的物质的量之比为 ,该混合物中CaCl2的质量分数为 .
解析:(1)c(Mg2+)==1.9×10-3 mol/L.
(2)n(K+)∶n(Ca2+)=n(KCl)∶n(CaCl2)=2∶1.
故w(CaCl2)=×100%=42.7%.
答案:(1)1.9×10-3 mol/L (2)2∶1 42.7%
10.有Na2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.4 mol/L,SO的物质的量浓度为0.7 mol/L,则此溶液中Na+的物质的量浓度为 ( )
A.0.1 mol/L B.0.15 mol/L
C.0.2 mol/L D.0.25 mol/L
解析:根据电荷守恒可知,混合溶液中Na+、Fe3+所带的正电荷总数等于SO所带的负电荷总数,于是有c(Na+)×1+c(Fe3+)×3=c(SO)×2,即c(Na+)+3×0.4 mol/L=2×0.7 mol/L,解得c(Na+)=0.2 mol/L.
答案:C
9.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO完全沉淀;如加入足量强碱并加热可得到c mol NH3,则原溶液中Al3+的浓度(mol/L)为 ( )
A. B. C . D.
解析:由氮原子守恒可知,n[(NH4)2SO4]= mol,
Al2(SO4)3中SO的物质的量为(b-)mol,因此原溶液中Al3+的浓度为:= mol/L.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com