
题目列表(包括答案和解析)
3.阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.将含有NO2和N2O4分子共约6.02×1023个的混合气,温度降至标准状况,其体积约为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数约为6.02×1022个
C.0.05molC5H12分子中所含共价键数约为6.02×1023
D.标准状况下,1molSiO2晶体中含有共价键数约为2×6.02×1023
2.下列说法不正确的是
A.在化学反应进行的过程中放出或吸收的热量称为反应热
B. 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热
C.对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量
D.在101KPa时 , 1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热
1.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C,14N+01n→14C+11H,下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.地球上活着的生物体内,由于新陈代谢作用也存在14C D.14CO2的摩尔质量为46
24.(12分)有一份含1 mol HCl和1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶液时,计算:
(1)当Ba(OH)2 溶液的滴加量到达 L时,开始有氢氧化镁沉淀析出?
(2)当滴加的Ba(OH)2 溶液为1L时,沉淀物的化学式为
每种沉淀物的物质的量为 。
(3)当生成沉淀总质量最大时,Ba(OH)2 溶液的滴加量为 L,此时沉淀的总质量为 g。
 (4)在以下坐标图中绘制出整个过程中产生沉淀的总物质的量(n)与加入 Ba(OH)2 溶液体积(V)之间的关系图。
(4)在以下坐标图中绘制出整个过程中产生沉淀的总物质的量(n)与加入 Ba(OH)2 溶液体积(V)之间的关系图。
23.(10分)已知

|
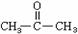 + CH3COOH
+ CH3COOH
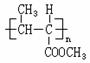

|
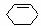 ,
,
一种用途较广泛的有机玻璃树脂--聚丁烯酸甲酯结构简式为:
合成这种高聚物有多种途径,其中一种合成途径因副产品污染少或无污染,原子利用率较高,符合“绿色化学挑战计划”的要求而被工业采用,其合成路线如下:
|
|
|
|

|

|

|
|
|

|
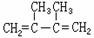
|
|
|

|

试解答下列问题:
(1)写出A-F代表的有机物的结构简式:
A C F
(2)写出反应D--E
(3)在上述加成反应的过程中,原子利用率最高的化学反应有(填编号):
。
22.(10分)氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
⑴制备氧化铜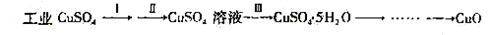
①步骤Ⅰ的目的是除不溶性杂质,操作是:___________________ _。
② 步骤Ⅱ的目的是除铁,操作是:滴加H2O2溶液,稍加热;当Fe2+完全转化后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制pH =3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH =1。控制溶液pH =3.5的原因是:_____________________ 。
③ 步骤Ⅲ的目的是得到CuSO4·5H2O固体,操作是:___________、过滤、水浴加热烘干。
⑵探究氧化铜的性质
① 取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3% H2O2溶液,只观察到A中有大量气泡,结论是:___________________________________ 。
② 为探究试管A中的反应速率,收集气体并测定其体积必需的实验仪器有:_____ 。
21.(12分)过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:
(2) Na2O2 、K2O2、 CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物
(3) (写电子式) 理由是
, (用简洁文字)
(4) 臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,化学方程式:
KI+O3+H2O→KOH+I2+O2(未配平)
①该反应中氧化剂的名称为 ,还原产物的化学式为
②配平后的化学方程式是
③若消耗0.1 mol氧化剂,反应中转移电子的物质的量为
20.(12)现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)
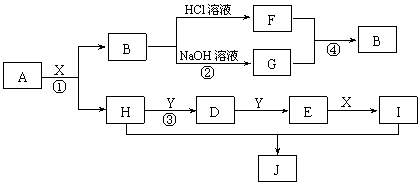
根据上述转化关系图回答:
(1)写出下列物质的化学式 X ;J
(2)物质H的电子式: ;物质J是属于哪种晶体类型: 。
(3)写出反应①的化学方程式 ;
写出反应④的离子方程式 。
19.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B |
C |
D |
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)B和E的最高价氧化物对应的水化物中酸性较强的是 (填化学式)
写出可以验证该结论的一个离子反应方程式
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 。
(3)写出由A、D、E、G四种元素组成的两种化合物相互反应的离子方程式
18.(14分)实验室用燃烧法测定某种氨基酸(CXHyOzNp的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
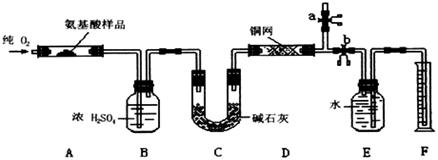
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是 ;之后则需关闭止水夹 ,打开止水夹 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点
燃 处的酒精灯。
(3)装置A中发生反应的化学方程式为 ;
(4)装置D的作用是 ;
(6)实验中测得N2的体积为V mL(已换算成标准状况)。为确定此氨基酸的分子式,还需得到的数据有(填字母) 。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的摩尔质量
(7)如果将装置中B、C的连接顺序变为C、B,该实验的目的能否达到?简述理由
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com