
题目列表(包括答案和解析)
28.(13分)在Mg(NO3)2和Al(NO3)3的混合溶液中,NO3-的物质的量为0.7mol。向该溶液中加入100mL 8mol·L-1的KOH溶液,使之充分反应。反应前,若Al3+的物质的量与混合溶液中离子总物质的量的比值为x。(不考虑Mg2+和Al3+的水解及水的电离所引起的离子总数的变化)
(1)x的取值范围是____________________________________。
(2)当KOH刚好完全消耗,且Al3+全部转化为AlO2-时,x的值为___________________。
(3)将(2)中的x的值记为x1,则当0<x≤x1时,反应生成的沉淀物的化学式为_____________,当x> x1时反应生成的沉淀物的化学式为_____________ 。
(4)若反应前Al3+的物质的量为a mol,则a=_____________(用含x的代数式表示) 。
27.(14分)某厂废液中含有大量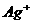 、
、 、
、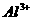 ,用下列图示方法进行分离(部分反应条件省略):
,用下列图示方法进行分离(部分反应条件省略):
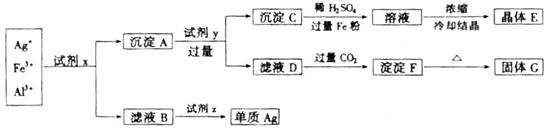
(1)写出下列物质的化学式:
试剂x_______________、试剂z_______________。
晶体E_______________、固体G_______________
(2)写出下列反应的离子方程式:
沉淀A+试剂y:_______________ 滤液D+过量 :_____________________
:_____________________
26.(本题15分)
I. 近期,科学家用NaNO3和Na2O在573K反应制得了离子化合物Na3NO4。
(1)经测定,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,则NO43-的电子式为______________________。
(2) Na3NO4与CO2或H2O都能剧烈反应,并转化为常见物质,写出这两个反应的化学方程式:________________________________、_________________________________。
II. 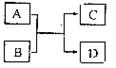 已知A、B、C、D分别代表中学化学常见物质(或粒子),其中A、B均为两种元素组成的化合物(或粒子),相互转化关系如右图(有关反应条件已略去)。请根据题目要求回答下列问题:
已知A、B、C、D分别代表中学化学常见物质(或粒子),其中A、B均为两种元素组成的化合物(或粒子),相互转化关系如右图(有关反应条件已略去)。请根据题目要求回答下列问题:
(1)若A、B两化合物相互反应生成非金属固体单质C和化合物D,且A的相对分子质量大于B的相对分子质量,则A、B的化学式分别为A________、B________,该反应中,氧化产物与还原产物的物质的量之比为____________。
(2)若A为5个原子构成的粒子,且A、B均为10电子粒子,含适量A、B粒子的溶液在加热条件下反应生成气体C和化合物D,则A的化学式为__________,C分子的空间构型为____________,含A、B粒子的溶液转化为C、D的离子方程式为_____________。
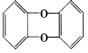
13.二噁英是一类物质的总称,这类物质的母体是
其中苯环上的氢原子如果被氯原子取代,所得到的物质的毒性是KCN的100倍。当有6个氯原子取代苯环上的氢原子时,所得的异构体数目是( )
A.7 B.9 C.10 D.11
第Ⅱ卷(非选择题 共174分)
12. 已知电解羧酸盐溶液可得烃类物质,例如
已知电解羧酸盐溶液可得烃类物质,例如
2CH2COONa+2H2 O CH3CH3↑+2CO2↑+H2↑+2NaOH
下列判断正确的是()
A.阳极产物是H2和NaOH
B.阴极产物是CH3CH3 和CO2
 C.阳极反应式是2CH2COO ̄+2e ̄= CH3CH3↑+2CO2↑
C.阳极反应式是2CH2COO ̄+2e ̄= CH3CH3↑+2CO2↑
D.阴极反应式是2H2O+2e ̄=2OH ̄+ H2↑
11.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器(如图)里,分别充有二氧化氮和空气,现分别进行下列两上实验:

(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )
A.(a)甲>乙(b)甲>乙 B.(a)甲>乙(b)甲<乙
C.(a)甲<乙(b)甲>乙 D.(a)甲>乙(b)甲=乙
10.下列各组离子,在指定的环境中,能大量共存的是( )
A.在pH=0的溶液中Na+、K+、MnO4-、Cl-
B.在c(H+)<c(OH-)的溶液中Na+、K+、S2-、SO32-
C.在中性溶液中Al3+、K+、SO42-、HCO3-
D.在酸性溶液中Fe2+、I-、Cl-、ClO-
9.某工厂排放的酸性废水中含有较多量的重金属 离子,这对农作物和人畜均有害.欲采用化学药剂法除掉有害成分,应选择下列药品中的( ).
离子,这对农作物和人畜均有害.欲采用化学药剂法除掉有害成分,应选择下列药品中的( ).
A.食盐和硫酸 B.铁粉和生石灰 C.胆矾和石灰水 D.苏打和硫酸
8.下列各组溶液,不加任何试剂(可加热)就可以区别的是( )
A.Na2S、Na2SO3、AgNO3、NaCl、NaOH
B.HCHO、CuSO4、NaOH、FeCl2、FeSO4
C.Br2、CH3CHO、CH3COOH、Ag(NH3)2Cl、NaHCO3
D.KAl(SO4)2、NaHSO4、Al2(SO4)3、KCl、MgCl2
7.2006年1月,我国研制出能在超低温状态下工作的镍氢电池。氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是:
H2+2NiO(OH) 放电充电2Ni (OH)2 , 根据此反应判断,下列叙述中正确的是( )。
A.电池放电时 ,电池负极周围溶液的pH不断增大 B.电池充电时, 镍元素被氧化
C.电池充电时,氢元素被还原 D.电池放电时,H2是正极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com