
题目列表(包括答案和解析)
13.(2010年云浮调研)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的离子方程式为____________,反应后得到的溶液呈________色。用此溶液进行以下实验:
(1)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为___________,此反应属于________(填反应类型)。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸直至溶液呈____色,即可制得Fe(OH)3胶体,离子方程式为______________。
(3)取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量HI稀溶液,边滴边振荡,会出现一系列变化。
①先出现红褐色沉淀,原因是_______________________。
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式___________。
③最后溶液颜色加深,原因是______,此反应的离子方程式是________。
(4)用稀盐酸代替HI稀溶液,能出现上述哪些相同的变化现象___(写序号)。
(5)已知明矾能净水,理由为____________________。
答案:Fe2O3+6H+===2Fe3++3H2O 黄
(1)FeCl3+3NaOH===Fe(OH)3↓+3NaCl 复分解反应
(2)红褐 Fe3++3H2OFe(OH)3(胶体)+3H+
(3)①HI是电解质,使胶体聚沉
②Fe(OH)3+3H+===Fe3++3H2O
③Fe3+将I-氧化,生成碘水 2Fe3++2I-===2Fe2++I2
(4)①② (5)Al3+水解生成Al(OH)3胶体,吸附水中悬浮的固体小颗粒,形成沉淀,使水变澄清
12.(2011年常德模拟)固体物质A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层结构。该物质稍微加热就分解成两种气体。
(1)A物质中的氢元素的化合价有:________、________。
(2)A是________(填“离子”或“共价”)化合物。
(3)A分解得到的两种气体的电子式是____________、____________。
(4)A溶于水后呈________(填“酸性”、“碱性”或“中性”),化学方程式为______________。
(5)A加热分解________(填“是”或“不是”)氧化还原反应。若是,书写反应的化学方程式_________________。
答案:(1)+1 -1 (2)离子
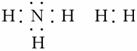 (3)
(3)
(4)碱性 NH4H+H2O===H2↑+NH3·H2O
NH3·H2O
 NH+OH-
NH+OH-
(5)是 NH4HNH3↑+H2↑
11.(2010年益阳质检)已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按下面框图进行反应。
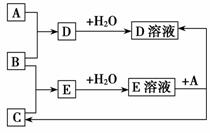
回答下列问题:
(1)A、B、C三种元素中的任意两种元素形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
(2)A、B、C三种元素中有一种是金属,则这种元素是A、B、C中的____,理由是_____________________。
(3)如果E溶液是一种强酸,则E的化学式为____________;
①A能否是铁________,理由是__________________;
②A能否是铜________,理由是___________________;
③A可能是________(任写两种)。
答案:(1)③⑤ (2)A 常温下金属单质都不是气体
(3)HCl ①不能 若E为HCl,A为Fe,则D为FeCl3,盐酸与Fe不能生成FeCl3 ②不能 Cu与盐酸不反应 ③Mg、Al、Zn
10.(2009年高考全国Ⅱ理综,改编)下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的
B.土壤胶粒的比表面积巨大且一般带负电,能吸附NH等营养离子,使土壤具有保肥能力
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
解析:胶体本身是不带电的,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;B项土壤保肥能力,利用的是土壤胶粒带负电荷,能吸收阳离子(如 NH 等)的原理,B项正确;溶液中溶质粒子的运动没有规律,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。
答案:BD
9.(2009年高考广东理基改编)下列说法正确的是( )
A.MgSO4晶体中只存在离子键
B.CaCl2、烧碱、聚苯乙烯、HD都是纯净化合物
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
解析:本题是对化学基础知识的考查。MgSO4中的SO中硫原子与氧原子以共价键结合,A错。聚苯乙烯是混合物,HD是单质(D是重氢原子),B错。丁达尔效应是胶体具有的性质,C对。玻璃是混合物,D错。
答案:C
8.(2011年滨州模拟)下列说法不正确的是( )
A.Na2O2、HClO、SO2等物质都具有漂白作用
B.液氨、液氯、液态氯化氢都是电解质
C.所有的置换反应都是氧化还原反应,而所有的复分解反应都是非氧化还原反应
D.非金属氧化物不一定是酸性氧化物,有些金属氧化物也能与强碱反应
解析:Na2O2、HClO利用其氧化性作漂白剂,SO2能与有机色素发生反应使其褪色;液氯和液氨不是电解质;置换反应有单质生成,有化合价的变化,所以所有的置换反应都是氧化还原反应,复分解反应没有化合价的变化,所以所有的复分解反应都不是氧化还原反应;非金属氧化物不一定是酸性氧化物,如CO,有些金属氧化物也能与强碱反应,如Al2O3。
答案:B
7.下列说法正确的是( )
①有化学键破坏的变化一定属于化学变化
②发生了颜色变化的一定是化学变化
③有气泡产生或固体析出的变化一定是化学变化
④用糯米、酒曲和水制成甜酒酿,一定是化学变化
⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
A.①②③④ B.④⑤
C.①③⑤ D.全部
答案:B
6.(2011年大庆模拟)若A+酸===盐+水,则A不可能属于( )
A.氧化物 B.单质
C.碱 D.电解质
解析:单质与酸反应不可能只生成盐和水,金属氧化物(如Na2O)、碱(如NaOH)与酸反应都生成盐和水,且都属于电解质。
答案:B
5.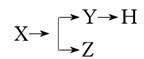 (2011年巢湖模拟)如图表示一些物质间的从属关系,不正确的是 ( )
(2011年巢湖模拟)如图表示一些物质间的从属关系,不正确的是 ( )
|
|
X |
Y |
Z |
H |
|
A |
分散系 |
胶体 |
溶液 |
烟 |
|
B |
电解质 |
酸 |
碱 |
盐 |
|
C |
元素周期表的纵列 |
主族 |
副族 |
卤族 |
|
D |
化合物 |
共价化合物 |
离子化合物 |
酸 |
解析:虽然酸、碱、盐都属于电解质,但盐不从属于酸,故B选项的有关物质间不符合图示的从属关系。
答案:B
4.(2008年高考广东化学)某合作学习小组讨论辨析以下说法:
①粗盐和酸雨都是混合物;
②沼气和水煤气都是可再生能源;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体。
上述说法正确的是( )
A.①②③④ B.①②⑤⑥
C.③⑤⑥⑦ D.①③④⑦
解析:粗盐中含有氯化镁等杂质,是混合物,酸雨中因溶解了二氧化硫等杂质,也是混合物,①正确;沼气属于可再生能源,但水煤气由炽热的煤和水蒸气反应制得,而煤为不可再生能源,所以水煤气为不可再生能源,故②错误;冰为固态水,干冰为固态CO2,既是纯净物又是化合物,③正确;不锈钢、硬币都是合金,④正确;盐酸和食醋为混合物,不是化合物,⑤错误;纯碱为Na2CO3,是盐不是碱,⑥错误;豆浆和雾都能发生丁达尔效应,均属于胶体,⑦正确。综上所述,选D。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com