
题目列表(包括答案和解析)
20.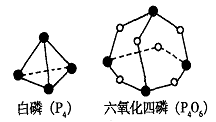 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示:
现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、O=O 498kJ·mol-1。则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol-1 B.一1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
第Ⅱ卷(非选择题,共60分)
18.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A.由“Cl2+H2O=HCl+HClO”反应可推出 “F2+H2O =HF+HFO” 反应也能发生
B. NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D.Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
19.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的硫化羰(COS),已知硫化羰分子中所有原子均满足八电子结构,结合所学元素周期表知识,下列说法正确的是
A.硫化羰分子中三个原子不在同一直线上 B.硫化羰属于非极性分子
 C.硫化羰沸点比CO2低
D.硫化羰的电子式为
C.硫化羰沸点比CO2低
D.硫化羰的电子式为
17.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中过氧离子和超氧离子的物质的量之比为
A 1 : 1 B 1 : 2 C 1 : 3 D 2 : 1
16.已知A和B是第二或第三周期元素,可在同一周期,也可以在不同周期,两者可形成AmBn 型离子化合物,若A的原子序数为x,则B的原子序数不可能是
A.x – m– n + 16 B.x – m – n + 8 C.x + m + n – 8 + 18 D.x – m – n
15.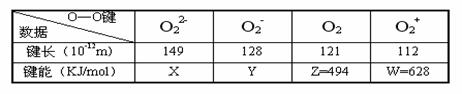 从实验测得不同物质中O-O之间的键长和键能的数据如下表所示:
从实验测得不同物质中O-O之间的键长和键能的数据如下表所示:
其中X、Y的键能数据尚未测定,但可根据规律性推导键能大小顺序为:W>Z>Y>X。则该规律性是
A.成键时电子数越多,键能越大 B.键长越长,键能越小
C.成键所用电子数越少,键能越大 D.成键时电子对越偏移,键能越大
14.下列具有特殊性能的材料中,由主族元素和副族元素形成的是
A.透明陶瓷材料硒化锌 B.吸氢材料镧镍合金
C.半导体材料砷化镓 D.新超导材料K3C60
13.有两种短周期元素X和Y,可以组成XY3,当Y的原子序数为M时,X的原子序数可能为 ① M-4 ② M+4 ③ M+8 ④ M-2 ⑤ M+6,其中正确的是
A.①②④ B.①②③⑤ C.①②③④⑤ D.①②⑤
12.运用元素周期律分析下面的推断,其中肯定错误的是
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体;H At不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸。
C.硫酸锶(SrS04 )是难溶于水的白色固体。
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体。
11.四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m > n,对下列叙述的判断正确的是
① a-b=n-m;② 元素的原子序数a > b > c > d;③ 元素非金属性Z > R;④ 最高价氧化物对应水化物碱性X > Y。
A.②③正确 B.只有③正确 C.①②③④正确 D.①②③正确
9.据美国《科学》杂志报道,意大利科学家合成了一种新型氧分子,它是由4个氧原子构成的O4分子,如果已知氧原子核外的电子并不都在同一个平面内运动,且分子中每个原子均达到8e一稳定结构,则下列关于该分子的叙述正确的是
A.O4象NH3一样是三角锥形分子 B.O4分子象白磷分子一样为正四面体构型
C.O4分子中的原子一定在同一个平面内 D.O4分子中的原子构成一个四边形
|
A.2 Na2O2 + 2 H2 O == 4NaOH + O2↑ B.NH4C l+ NaOH == NaCI + H2O + NH3↑
C.Mg3N2 + 6 H2 O == 3Mg(OH)2↓+2NH3↑ D. CaC2 + 2H2 O→Ca(OH)2 + CH≡CH↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com