
题目列表(包括答案和解析)
30.(6分)某天然碱的组成为x Na2CO3·yNaHCO3· zH2O,将称取的4.56g样品于300℃加热分解至完全(300℃ Na2CO3不分解),得到残留固体3.71g,分解产生的气体通入足量饱和的澄清石灰水中,完全吸收后可得到0.500g沉淀。请计算:
(1)该样品中结晶水的质量分数;
(2)通过计算确定该天然碱的化学式。
杭七中 高三第二次月考化学答题卷(06.10)
高三第二次月考化学答题卷(06.10)
第Ⅰ卷(选择题,共40分)
29.(6分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5 g(相当于钙元素600 mg),成人每天服用1片。”
(1)“1.5 g碳酸钙与600 mg的钙”的计量关系是如何得出来的,请列式表示;
(2)该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加 (NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1L溶液,取其20mL,然后用0.01 mol/L KMnO4 溶液滴定,反应中用去6 mL KMnO4溶液,发生的离子反应为:
2MnO4― + 5H2C2O4 + 6H+ == 2Mn2+ + 10CO2↑+ 8H2O
试通过计算回答该片剂中碳酸钙的含量,并仿照药品说明书的文本表达出来。
28.(6分)亚硝酸钠NaNO2可用做水泥施工的抗冻剂。它易溶于水,有咸味,既有氧化性,又有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里的亚铁离子氧化为三价铁离子而使人中毒,在建筑工地上多次发生把亚硝酸钠误作食盐食用,导致民工中毒的事件。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下反应:3HNO2 == 2NO↑+ HNO3 + H2O。
试从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质作试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。
(1)方法一(只用一种试剂),试剂 ▲ ,现象 ▲ ;
(2)方法二,试剂 ▲ ,现象 ▲ ,写出反应的离子方程式是 ▲ 。
27.(6分)请设计实验用氯化钙固体和其他有关试剂(硝酸银价格昂贵不能使用),制取一定量纯净的硝酸钙固体。
(1)写出表示制取硝酸钙的化学方程式: ▲ , ▲ ;
(2)简述实验的操作步骤(不要求回答使用的仪器,但要求回答试剂的用量:少量、适量或过量) ▲ 。
26.(6分)下列有关实验的叙述,正确的是 ▲ (填序号)。
A.配制500mL某物质的量浓度的溶液,可用两只250mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.无法用分液漏斗将甘油和水的混合液体分离
D.用酸式滴定管量取20.00mL高锰酸钾溶液
E.为了测定某溶液的pH,将经水润湿的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
F.用浓氨水洗涤做过银镜反应的试管
G.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
H.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
J.在氢氧化铁胶体中加少量硫酸会产生沉淀
K.用结晶法可以除去硝酸钾中混有的少量氯化钠
25.(6分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出元素符号:A ▲ 、B ▲ ;
 (2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ▲ ;
(2)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ▲ ;
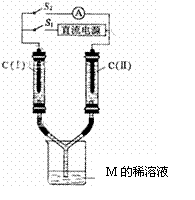
(3)如图所示装置,两玻璃管中盛满A、B、C三种元素组成的化合物M的稀溶液,C(Ⅰ)、C(Ⅱ)为多孔铂电极。接通S1后,两玻璃管中有气体生成,C(Ⅰ)极的玻璃管内的气体约是C(Ⅱ)的二分之一。一段时间后(两玻璃管中液面未脱离电极),断开S1 ,接通S2,电流表的指针发生偏转。此时:
① C(I)的电极名称是 ▲ (填写“正极”或“负极”);
② C(II)的电极反应式是 ▲ 。
24.(6分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
- |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
- |
|
最低价态 |
- |
- |
-2 |
- |
-4 |
-3 |
-1 |
- |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 ▲ (填写编号);
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 ▲ (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ▲ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ▲ ;
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是 ▲ (写分子式)。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ▲ ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 ▲ ;
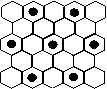
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,则该物质的化学式为 ▲ 。
23.(4分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为
▲ ;
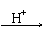 (2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO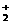 ,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:VO
,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:VO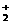 +H2C2O4
VO++CO2+H2O(未配平),
+H2C2O4
VO++CO2+H2O(未配平),
其中还原剂是 ▲ 。若消耗0.9 g草酸,所对应钒元素质量是 ▲ g。
22. (6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 ▲ 、 ▲ 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ▲ ;
(6分)右图中A、B、C、D四条曲线是表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示 ▲ 、 ▲ 族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ▲ ;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是
▲ 。
21.(8分)下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,
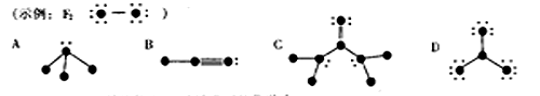
根据各图表示的结构特点,写出该分子的化学式:
A ▲ 、 B ▲ 、C ▲ 、D ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com