
题目列表(包括答案和解析)
5.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
解析:由m=ρV知,体积和密度相等的O2和O3的质量相等,B项错;n(O2)∶n(O3)=∶=3∶2,C项错;V、T一定时,==3∶2,A项错;质量相等的O2和O3原子数目相等,D项正确。
答案:D
4.在一定温度和压强下,1 L X气体和1 L Y气体完全反应后生成1 L水蒸气和1 L氮气。X、Y两种气体是( )
A.H2、N2O4 B.H2、N2O3
C.H2、N2O D.H2、NO2
解析:由题知:X+Y===H2O(g)+N2,由质量守恒知1 mol X和1 mol Y中共含有2 mol H、1 mol O、2 mol N,分析各选项中物质的组成,只有C项符合。
答案:C
3.(2010年潍坊月考)由阿伏加德罗常数(NA)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有( )
A.1摩尔水的质量 B.1摩尔水蒸气的质量
C.1摩尔水的体积 D.1摩尔水蒸气的体积
解析:A、B选项中,1摩尔水或水蒸气的质量都为m水NA。C选项中,水分子间间距和水分子大小相比可以忽略,1摩尔水的体积为NAV水。D选项中,水蒸气分子间间距比分子直径大得多,仅由题给条件不能确定1摩尔水蒸气的体积。
答案:D
2.(2009年高考广东化学)设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1nA Fe3+
解析:A项,K2SO4中阴离子为SO,1 mol SO所带负电荷为2 mol,A错误;B项,乙烯和环丙烷的最简式相同,均为CH2,28 g混合气体有2 mol CH2,故含4 mol H,B错误;D项,Fe3+在溶液中发生水解,含0.1 mol FeCl3的溶液中,Fe3+的物质的量要小于0.1 mol,D错误。
答案:C
1.(2010年高考江苏化学)设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI===KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
D.常温常压下,22.4 L乙烯中C-H键数为4NA
解析:依据氮原子守恒可得A项正确;B项,1 mol羟基中的电子数为9NA;C项,反应中每生成3 mol I2转移5 mol电子;D项,是非标准状况。
答案:A
14.根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有n个OH-,则可求出此溶液中________为____________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中________为____________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为____________。
答案:(1)物质的量浓度 mol·L-1
(2)溶质的质量分数
(3)溶质的质量分数 45.6%
(4)物质的量浓度 mol·L-1
13.一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
(1)原NaOH溶液的质量分数为________。
(2)所得溶液中Cl-的物质的量为________mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)=________。
解析:本题综合考查元素及其化合物的有关反应及物质的量应用于化学方程式的计算、守恒法的巧用。发生的有关反应方程式为:
①H2+Cl22HCl,
②HCl+NaOH===NaCl+H2O,
③2NaOH+Cl2===NaCl+NaClO+H2O。
(1)w(NaOH)
=×100%=10.7%。
(2)溶液中的溶质为NaCl和NaClO的混合物。因n(NaOH)=100 mL×10-3 L/mL×3.00 mol/L=0.30 mol,由钠原子、氯原子守恒:n(Cl)=n(Na)=n(NaCl)+n(NaClO)=0.30 mol,故n(Cl-)=n(NaCl)=0.30 mol-0.05 mol=0.25 mol,而反应③产生的n(NaCl)=n(NaClO)=0.05 mol,故反应②产生的n(NaCl)=0.25 mol-0.05 mol=0.20 mol。
(3)反应过程中,共用n(Cl2)=n(Cl)=0.30 mol×=0.15 mol。参加反应的n(H2)=n(HCl)=n(NaCl)=×0.20 mol=0.10 mol,故n(Cl2)∶n(H2)=0.15 mol∶0.10 mol=3∶2。
答案:(1)10.7% (2)0.25 (3)3∶2
12.下图是硫酸试剂瓶标签上的内容:
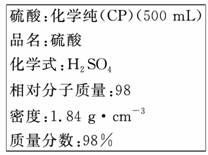
(1)该硫酸的物质的量浓度是_______mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol/L的稀H2SO4,则需要取____mL的该硫酸。将上述硫酸进行稀释的实验操作为_____。
(3)在配制4.6 mol/L稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:____________。
②定容时仰视观察液面:____________。
③用量筒量取浓H2SO4时俯视:____________。
(4)在实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应_________;加蒸馏水到刻度约1 cm-2 cm处应_________;俯视观察到液面刚好到达刻度线,应_______________;移液时不慎将少量液滴滴在容量瓶外面,应__________________。
答案:(1)18.4
(2)62.5 将量取的浓H2SO4沿烧杯内壁缓缓地倒入盛有适量水的烧杯中,并用玻璃棒不断搅拌
(3)①偏高 ②偏低 ③偏低
(4)重新配制 改用胶头滴管滴加 视线与刻度线相平并改用胶头滴管滴加 重新配制
11.(1)指出在使用下列仪器(已洗净)或用品的第一步操作:

(2)配制物质的量浓度为0.2 mol/L的NaOH溶液500 mL,请回答下列问题:
|
应称量NaOH的质量/g |
已给仪器 |
除已给仪器外还需要的其他仪器 |
|
|
烧杯、托盘天平、药匙 |
|
(3)下列操作对配制的NaOH溶液浓度有偏高影响的是________。
A.称量NaOH固体时,露置在空气中的时间过长
B.选用的容量瓶内有少量的蒸馏水
C.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
D.在定容时仰视容量瓶刻度线
解析:(1)用石蕊试纸检验气体时,要先用蒸馏水润湿;使用容量瓶前要先检验是否漏水;氨气极易溶于水,收集前要先将集气瓶干燥。
(2)n(NaOH)=0.2 mol·L-1×0.5 L=0.1 mol
m(NaOH)=0.1 mol×40 g·mol-1=4.0 g
配制500 mL 0.2 mol/L的NaOH溶液时,应称取4.0 g NaOH,需要的仪器有药匙、烧杯、托盘天平、玻璃棒、500 mL容量瓶、胶头滴管等。
(3)根据c==
A项,NaOH潮解,使m偏低,c偏低;
B项,容量瓶内有少量蒸馏水对m和V都无影响,对c无影响;
C项,溶解后未冷却至室温,直接将溶液注入容量瓶中,V偏低,c偏高;
D项,定容时仰视容量瓶刻度线,V偏高,c偏低。
答案:(1)
|
用蒸馏水湿润 |
检验是否漏水 |
干燥集气瓶 |
(2)
|
4.0 |
|
500 mL容量瓶、玻璃棒、胶头滴管 |
(3)C
10.质量分数为a%,物质的量浓度为c mol·L-1的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为( )
A.等于2c mol·L-1 B.大于2c mol·L-1
C.小于2c mol·L-1 D.在c-2c mol·L-1之间
解析:由溶质质量不变可得ρ1V1·a%=ρ2V2·2a%,=2·>2,再由溶质物质的量不变可推出B正确。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com