
题目列表(包括答案和解析)
5.
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的
 烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2 + 7O2 2MoO3 + 4SO2;
烯烃复分解催化剂。工业上冶炼钼的化学原理为①2MoS2 + 7O2 2MoO3 + 4SO2;
②MoO3 + 2NH3·H2O = (NH4)2MoO4 + H2O; ③(NH4)2MoO4 + 2HCl = H2MoO4↓+ 2NH4Cl;
 ④H2MoO4 MoO3
+ H2O;⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是( )
④H2MoO4 MoO3
+ H2O;⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是( )
A、MoS2煅烧产生的尾气可直接排空
B、MoO3是金属氧化物,也是碱性氧化物
C、H2MoO4是一种强酸
D、利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3:3:2
3.下列有关叙述正确的是( )
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
 B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C.右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H= - Q kJ/mol(Q>0)
D.化工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处
|
|
|
|
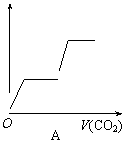

2.奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维
下列说法正确的是( )
A、羊毛与聚酯纤维的化学成分相同 B、聚酯纤维和羊毛一定条件下均能水解
C、该聚酯纤维单体为对苯二甲酸和乙醇 D、由单体合成聚酯纤维的反应属加聚反应
1.俄罗斯杜布纳核研究所和美国劳伦斯利弗莫尔实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布, 他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为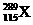 。下列有关叙述正确的是( )
。下列有关叙述正确的是( )
A.115号元素衰变成113号元素是化学变化 B.核素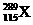 中中子数与质子数之差为174
中中子数与质子数之差为174
 C.113号元素最高正价应为+3 D.115号与113号元素的原子质量比为115:113
C.113号元素最高正价应为+3 D.115号与113号元素的原子质量比为115:113
27.(6分)将总物质的量为4mol的Na2O2和Al2(SO4)3的混合物投入足量水中,充分反应后生成y mol沉淀(y>0)。
(1)试分步写出所有可能发生反应的化学方程式
(2)若以x表示原混合物中Na2O2的物质的量,试建立y=f(x)的函数关系式,将x的取值和y=f(x)关系式填写在表内(可不填满,也可补充)。
|
序号 |
x值 |
y=f(x) |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
26.(4分)在537℃、1.01×105 Pa和催化剂存在的条件下,向某密闭容器中充入1 mol SO2和0.5molO2,此时体积为100 L,在温度和压强不变条件下反应达到平衡时,SO3体积分数为0.91。若保持温度和压强不变,充入1 mol SO3,则平衡时SO2体积分数为______ ;若保持温度和体积不变,充入a mol SO2和b mol O2,且a∶b=2∶1,反应达到平衡时SO3体积分数仍为0.91,则a =_____ _ 。
24、(10分)A、B、C是三种常见的短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液PH>7;乙溶液PH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
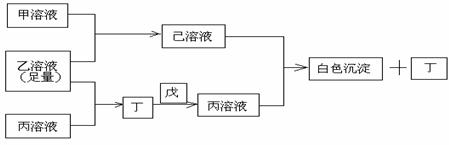
请回答:
(1)写出C元素的原子结构示意图______,写出丁和戊的电子式_______、______;
(2)用有关化学用语(离子方程式与必要文字说明)解释:
乙溶液呈酸性的原因 ____________________________
丙溶液呈碱性的原因____________________________
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________ ;
②己溶液+丙溶液→丁______________________________ 。
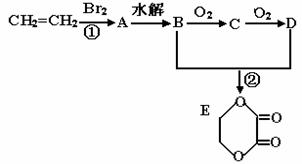 25.(8分)由乙烯和其它无机原料合成环状 化合物其合成过程如下(水及其它无机产物均已省略):
25.(8分)由乙烯和其它无机原料合成环状 化合物其合成过程如下(水及其它无机产物均已省略):
请分析后回答下列问题:
(1)D物质中的官能团为__________________________;
(2)反应的类型分别是①_____________、②________________;
(3)C物质的结构简式_________________,物质X与A互为同分异构体,则X的结构简式为______________________,X的名称为_________________;
(4)反应②的化学方程式(注明反应条件)_______________________________
23、(6分)A、B、C、D均为常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A,B与D可形成分子X,也可形成阳离子Y,
X和Y在水溶液中酸碱性正好相反,C+的焰色反应呈黄色。
(1)C元素在周期表中的位置是 ,液态X类似B2A也能微弱电离产生电子数相同的两种离子,则液态X的电离方程式:
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。则M、N分别为 (填化学式)若将0.1mol/L M和0.2mol/L N两溶液等体积混合所得溶液中离子浓度的大小顺序为
22.(7分)某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:该反应的气体产物全部是二氧化碳。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式: 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g。得出原假设不成立,理由是
。
(6)得出结论:根据数据处理结果判断反应产生的气体是 ,
该实验中发生的化学方程式为 。
(7)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
21.(8分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的白光”,“纸漏斗的下部被烧穿,有熔融物落入沙中”。
已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1535 |
|
沸点(℃) |
2467 |
2750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放出大量的热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金。你认为他的解释是否合理? (填“合理”或“不合理”)。
(2)根据你所掌握的知识找出一种验证产物中有单质Fe的最简单方法:
。
(3)设计一个实验方案,证明上述所得的熔融物中含有金属铝。填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com