
题目列表(包括答案和解析)
20.(17分)在实验室常用锌粒跟稀硫酸起反应而制得的氢气,含有水蒸气等杂质;被干燥后,经催化剂的作用,再跟干燥的氮气起反应,生成氨气。
(1)根据上述要求,小强同学尝试安装了以下装置。
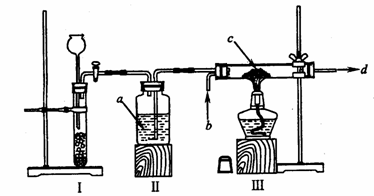
试填空:
① 请指出上述装置中的错误之处:________________;________________。
② 装置Ⅲ的作用是________________。
③ 写出箭头所标试剂的名称:a_________; b__________; c__________; d_________。
再简答下列问题:
(2)为什么不能用浓硫酸跟锌起反应来制得氢气?
________________________________________________________________。
(3)为什么不能用铜跟稀硫酸起反应来制取氢气?
________________________________________________________________。
(4)干燥的氢气里可能混用二氧化硫、硫化铜、氮气、二氧化碳等杂质。把这种氢气顺次通过硝酸铅溶液和氢氧化钠溶液,每种溶液能除去什么杂质?
________________________________________________________________。
(5)怎样检验生成的氨气?
________________________________________________________________。
19.(3分)下列实验操作能达到的预期效果的是______________。
A.用pH试纸测定某液体是否为酸。
B.实验室制取乙烯时必须将温度计的水银球插入反应液中,以控制反应液的温度。
C.分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现。
D.向2 mL 2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液。
E.向20 mL沸水中滴加数滴饱和FeCl3的溶液,加热片刻,可制得Fe(OH)3胶体。
F.将10滴溴乙烷加入1 mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子。
18.在一固定体积的密闭容器中,可逆反应,nA(g)+mg(B) pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
pC(g)已经达到平衡状态。已知n+m>p,正反应为放热反应。下列分析结论中正确的是
①升温,c(B)/c(C)的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=v(A)n/m。
A.③④⑤ B.②③④ C. ③④⑥ D.①②③
第Ⅱ卷(非选择题 共76分)
17.科学家发现,不管化学反应是一步完成或分几步完成,该反应的热效应是相同的。已知在25℃,105Pa时,石墨、一氧化碳的燃烧热分别是393.5 kJ·mol-1和283.0 kJ·mol-1,下列说法或方程式正确的是
A.在相同条件下:2C(石墨)+O2(g)=2CO(g);ΔH=-110.5 kJ·mol-1
B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C.在相同条件下:C(石墨)+CO2(g)=2CO(g); ΔH=+172.5 kJ·mol-1
D.若金刚石燃烧热大于石墨的燃烧热,则石墨转变为金刚石需要吸热
16.如图是某公司批量生产的笔记本电脑所用的甲醇燃料电池的构造示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,该电池总反应式为:2CH3OH+3O2=2CO2+4H2O。下列有关该电池的说法错误的是
A.
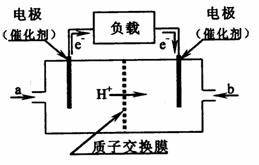 右边的电极为电池的负极,b处通入的是空气
右边的电极为电池的负极,b处通入的是空气
B. 左边的电极为电池的负极,a处通入的是甲醇
C. 电池负极的反应式为:2CH3OH+2H2O-12e-=2CO2+12H+
D. 电池正极的反应式为:3O2+12H++12e-=6H2O
15.已知某温度下0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),则下列关系中一定正确的是
a+)=c(HB-)+2c(B2-)+c(OH-) a+)=0.1 mol·L-1≥c(B2-)
C.c(H+)·c(OH-)=10-14 D.溶液的pH=1
14.有t℃的a g KCl不饱和溶液,其质量分数为ω1,采取措施后使其变为b g饱和溶液,其溶质质量分数为ω2,下列说法正确的是
A.a一定小于或等于b B. aω1一定等于b ω2
C.t℃时KCl溶解度一定大于100ω1 D. ω1一定大于ω2
13. 假设某氯化钠米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同,其结构模型如右图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数是
假设某氯化钠米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同,其结构模型如右图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数是
A.66.7% B.87.5% C.92.9% D.96.3%
12.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2取1.55 g该固体恰好与10 mL 4mol·L-1硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为
A.1 B.2 C.3 D.5
11.下列离子反应方程式正确的是
A.将少量SO2气体通入NaClO溶液中:2ClO-+SO2+H2O SO
SO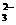 +2HClO
+2HClO
B.硫化氢气体通入硝酸铅溶液产生黑色硫化铅沉淀:H2S+Pb2+ PbS↓+ 2H+
PbS↓+ 2H+
C.向偏铝酸钠溶液中通入过量CO2:AlO CO2+2H2O
CO2+2H2O Al(OH)3↓+HCO
Al(OH)3↓+HCO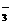
D.溴化亚铁溶液中滴入过量的新制氯水:2Fe2++Cl2 2Fe3++2Cl-
2Fe3++2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com