
题目列表(包括答案和解析)
21.(1)0.2 mol (2)SO2、NO2 (3)A、C
20.(1)①装置Ⅰ的长颈漏斗下端尖嘴未插入酸液内;装置Ⅱ洗瓶长、短导管反向连接。
②在催化剂存在下,将氢气、氮气混合加热制备氨气。
③a.浓硫酸;b.氮气;c.铁粉;d.氨气、氢气和氮气的混合气体。
(2)因为浓硫酸具有强氧化性,跟锌反应生成二氧化硫。t
(3)因为铜不活动,不能从稀硫酸中置换氢。
(4)硝酸铅溶液能除去硫化氢。
氢氧化钠溶液能除去二氧化碳和二氧化硫。x
(4) 使湿润的红色石蕊试纸变蓝(或答闻气味,或跟盐酸生成白烟等)。
19.B、D、E
1.B 2.C 3.D 4.C 5.B 6.C 7.B 8.A 9.BD 10.AB 11.BC 12.C 13.D 14.C 15.B 16.A 17.CD 18.A
26.(10分)乙烯和乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45 g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)=_________。
(2)当a=1时,且反应后CO和CO2混合气体的物质的量为反应前氧气的 时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
时,则b=______,得到的CO和CO2的物质的之比n(CO):n(CO2)=__________________。
(3)a的取值范围是____________________________。
(4)b的取值范围是____________________________。
吉林一中2007届高三教学调研测试
25.(7分)已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO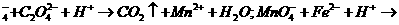 Fe3++Mn2++H2O。
Fe3++Mn2++H2O。
现称取草酸亚铁[FeC2O4]样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol·L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1)
试分别配平下列两个离子反应式。
(2) 求样品中草酸亚铁的质量分数。
24.(13分)据报道,目前抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种,它与雷米封同时服用,可以产生协同作用。已知:
请回答下列问题:
(1)
 写出下列反应的化学方程式:
写出下列反应的化学方程式:
A→B:______________________
(2)写出下列物质的结构简式:
C__________________,D_______________________。
(2) 指出反应类型:反应Ⅰ___________,反应Ⅱ______________,反应Ⅲ___________。
(3) 所加试剂名称:X___________,Y___________________。
23.(10分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色;A难溶于水,但在酸性条件下可发生水解反应,得到B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液反应。
(1)A可能发生的反应有__________(选填序号)。
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是_____________、________________。
(3)B分子中没有支链,其结构简式是_________,与B具有相同官能团的同分异构体的结构简式是__________________。
(4)由B制取A的化学方程式是_______________。
(5)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:

天门冬氨酸的结构简式是__________________________。
22.(8分)下图是某些常见物质的转化关系图,图中部分反应物或生成物没有列出。其中A是农业生产中常用的化肥,且分解得到相等物质的量的B、C、D。B是直线型非极性分子, D、J是工业上用途很广的两种重要的化工原料,H、I是典型的大气污染物,E是一种耐高温材料。
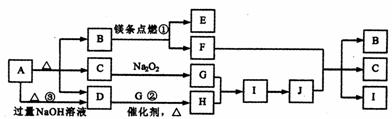 请按要求填空:
请按要求填空:
(1) D的电子式_________,其分子的空间结构为_____________形。
(2) 反应①、②的化学方程式为:
①______________________________;②_______________________。
(3) 反应③的离子方程式为_________________________________________。
21.(8分)将4 mol SO3气体和4 mol NO置于2 L容器中,在一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):
2SO3(g) 2SO2+O2;2NO+O2
2SO2+O2;2NO+O2 2NO2。
2NO2。
(1) 当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为____________mol。
(2) 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和______,或NO和________(填分子式)。
(3) 若在另外一个2 L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol·L-1、0.2 mol·L-1,当反应达到平衡时,各物质的浓度可能是________(选填字母代号)。
A. c(NO)=0.35 mol·L-1或c(NO)=0.09 mol·L-1
B. c(NO2)=0.4 mol·L-1
C. c(NO2)=0.35 mol·L-1
D. c(O2)=0.2 mol·L-1或c(NO)=0.4 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com